¿Eliminar cadáveres con ácido fluorhídrico?
Escrito por Quimitube el 23 febrero
Seguro que habéis visto alguna película en la que un asesino se deshace de un cadáver haciéndolo reaccionar con ácido sulfúrico y luego tirando los restos por algún retrete. No he visto la serie Breaking Bad (algunos lo tacharán de sacrilegio, más siendo química, y porque por lo visto se ha convertido en una serie de culto), pero sí que vi algunos de los primeros episodios y en uno de ellos se deshacían de un cadáver inoportuno por reacción en una bañera; aunque no recuerdo exactamente qué ácido o mezcla de ellos utilizaron, sí que recuerdo que se comió la bañera y que todo el proceso se convertía en una auténtica chapuza.
Bien podían haber empleado ácido fluorhídrico para este menester, algo tan simple como HF. Sí, un átomo de flúor unido a un átomo de hidrógeno da lugar a un compuesto con unas propiedades corrosivas brutales.

En concreto, cuando hablamos de «ácido fluorhídrico» nos referimos a la disolución acuosa del compuesto anterior, el fluoruro de hidrógeno, que es bastante soluble en agua.

El ácido fluorhídrico es la solución acuosa del fluoruro de hidrógeno, HF. Fuente: Wikipedia.
Se trata de un producto capaz de producir quemaduras muy graves en la piel y en las vías respiratorias, dolorosas y de muy difícil curación, ya que la presencia de fluoruro hace que el calcio, necesario para la curación de una quemadura, precipite como cloruro cálcico, CaCl2. Las quemaduras tienen una pinta terrible:
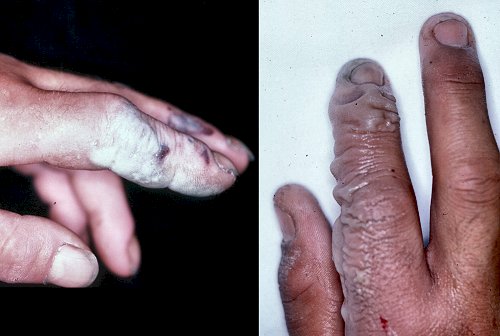
Quemaduras producidas por el ácido fluorhídrico. El contacto con HF no produce la quemadura de forma inmediata, sino que tarda en aparecer un día o dos y tiene este mal aspecto. Fotografía: Wikipedia
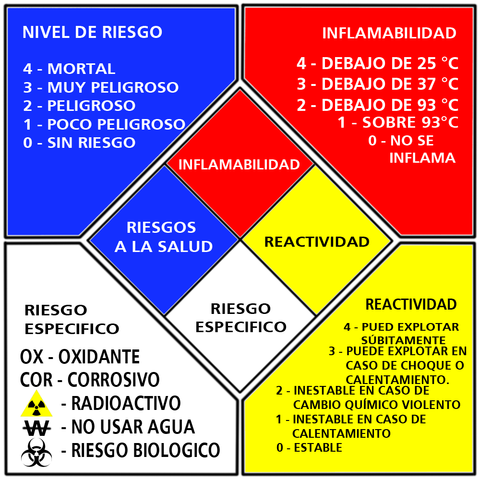
Existe una norma estadounidense que asigna a cada sustancia un «diamante de materiales peligrosos», un rombo dividido en 4 partes, cada una de ellas representando un peligro: nivel de riesgo, inflamabilidad, riesgos específicos y reactividad. Pues bien, el fluoruro de hidrógeno tiene un 4 en nivel de riesgo, el mayor posible, que implica que es una sustancia mortal.
Rombo o diamante de productos peligrosos según la norma estadounidense NFPA 704
Es tan reactivo que incluso es capaz en determinadas circunstancias de corroer el vidrio, por lo que es más frecuente manipularlo en materiales plásticos.
Sin embargo, como ácido, es más bien débil, ya que su constante de acidez es superior a 3, cuando la constante de acidez de otros ácidos es prácticamente infinito (la del ácido clorhídrico, HCl, por ejemplo, o la del ácido sulfúrico, H2SO4). Esto significa que el compuesto HF no está totalmente ionizado en disolución acuosa, sino que tendremos el siguiente equilibrio químico:
HF + H2O ⇔ F– + H3O+
Paradójicamente el hecho de que no sea un ácido tan fuerte como otros ácidos minerales lo hace más peligroso, ya que penetra con más facilidad en los tejidos blandos, como el tejido adiposo, y allí se acumula, aumentando el daño causado por su toxicidad.
Para producirlo, se utiliza la siguiente reacción:
CaF2 + H2SO4 → 2 HF + CaSO4
Es decir, la combinación de ácido sulfúrico con fluoruro de calcio, presente en el mineral fluorita, un mineral muy bonito que generalmente es de color violeta.

La fluorita es un mineral compuesto principalmente por fluoruro de calcio, CaF2, que se utiliza como materia prima en la fabricación de fluoruro de hidrógeno, HF. Fuente: Wikipedia
Como hemos dicho, el HF es una sustancia mortal pero… ¿qué pasa si lo que reacciona con ello ya está muerto? ¿Se puede emplear para disolver un cuerpo? En este curioso vídeo de Periodic Table of Videos lo comprueban con un trozo de pollo, ya que estaría feo probarlo con un trozo de ser humano. En concreto comparan qué le ocurre a un muslo de pollo en ácido fluorhídrico, en ácido clorhídrico y en ácido sulfúrico.
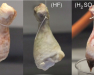
Como podéis ver en el vídeo, media hora después de que se hayan sumergido no ha ocurrido nada. Un día después, el muslo del ácido sulfúrico ha empezado a descomponerse, así como el pollo que se encuentra en ácido clorhídrido, pero al del ácido fluorhídrico se le ve distinto. Mientras que la parte no sumergida todavía tiene apariencia de carne normal en los dos primeros, el pollo en HF tiene pinta de cadáver zombi.
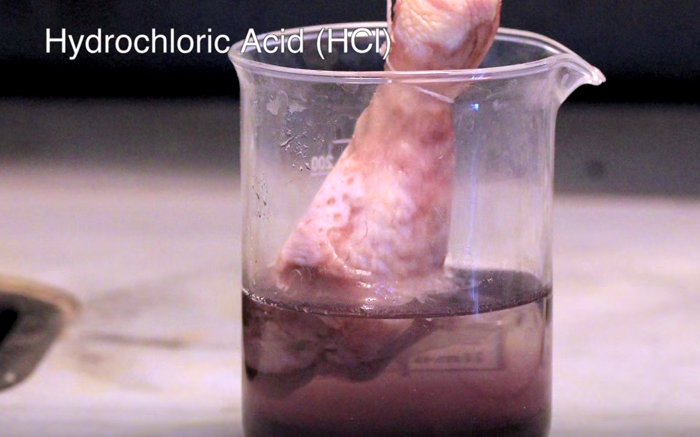
Muslo de pollo en HCl después de un día
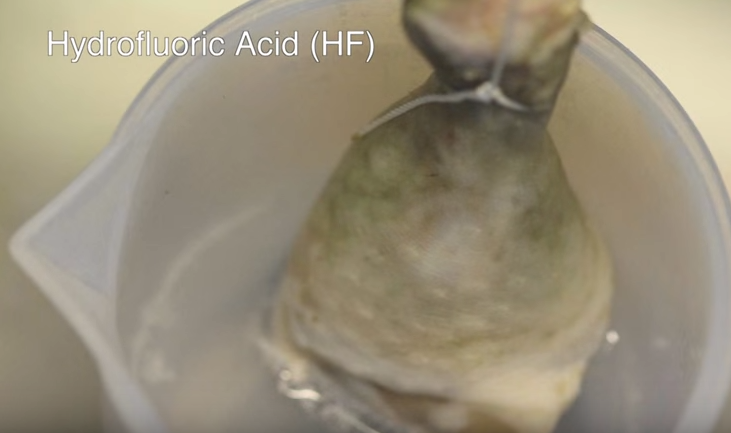
Muslo de pollo en HF después de un día
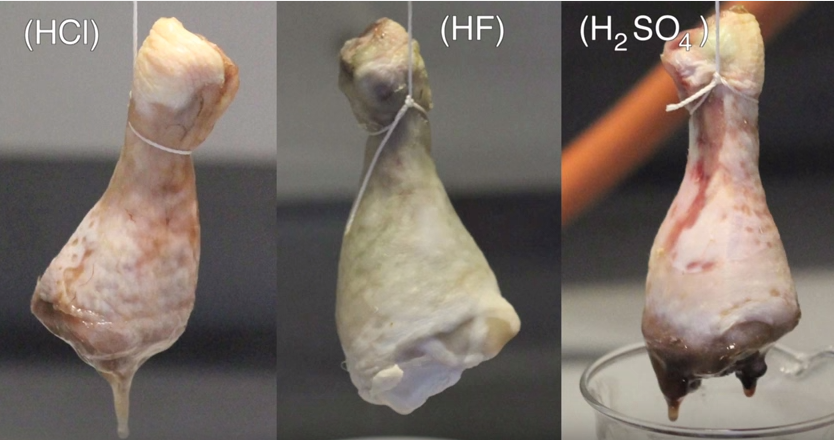
El motivo por el que ocurre esto es porque la mioglobina que tenemos en los músculos, que tiene un color similar al de la hemoglobina, es destruida por el HF y hace que el pollo tome ese color mortuorio tan característico. Sin embargo yo diría que el muslo ha desaparecido más cuando lo introducimos en HCl o en H2SO4, así que probablemente estos ácidos sigan siendo más útiles para deshacerse de un cadáver un tanto incómodo.





En «Breaking Bad» el episodio de la bañera tiene que que ver con la lixiviación de un cadáver con HF, algo que químicamente no termina de funcionar, ya que la reacción ni es tan rápida, ni desde luego tan completa como para disolver tejidos orgánicos. Ya lo demostraron los «Cazadores de Mitos»:
https://www.youtube.com/watch?v=u6EGbz2SJmI
Quizá en la serie de TV, no quisieron dar pistas de cómo disolver un cadáver en determinados compuestos químicos, y se tomaron la pequeña licencia del HF, pero como químico debo decir que la asesoría técnica de la serie es notable, a pesar de tener alguna que otra incorrección química
Desde un punto de vista técnico, creo que lo más adecuado en vez del HF, sería una hidrólisis alcalina con NaOH, método utilizado en granjas para procesar cadáveres de animales. Se forma un residuo, obteniéndose una sustancia pulverolenta una vez molturado dicho residuo.
Saludos
R. Herrero, 9 Años Antes
Muchísimas gracias por la información adicional tan interesante y disculpa de nuevo. Un saludo.
QuimiTube, 9 Años Antes
Oye, gracias por el consejo
Jajaj broma
Caro, 9 Años Antes
Era HF en Breaking Bad!! jajaja, aquí te dejo un enlace dónde explican los aciertos y fallos de la ciencia en la serie y aparece el ácido fluorhídrico 😉 http://www.sharpmindsweb.net/la-quimica-de-breaking-bad/
ununcuadio, 9 Años Antes
[…] Breaking Bad reloaded: ¿eliminar cadáveres con ácido fluorhídrico? […]
Lo Mejor de la Semana (21 – 27 de febrero) | Hablando de Ciencia | Artículos, 9 Años Antes
No entiendo la causa de la censura a mi comentario sobre la manera de disolver un cadáver y lo visto en la serie de TV «Breaking Bad». No creo haber ofendido a nadie exponiendo mi punto de vista como profesional de la química que soy. En fin, nada nuevo bajo el sol.
Saludos
Rubén Herrero, 9 Años Antes
¡Hola Rubén! Discúlpame, no hay censura alguna, lo que ocurre es que tengo muy poco tiempo por cuestiones personales para dedicarle a la página y se me acumulan comentarios pendientes (más de 800, ahora mismo :S) por lo que no lo pude aprobar. Por supuesto que tu punto de vista es válido y de eso va esta entrada, ¿no? De disolver cadáveres 🙂
QuimiTube, 9 Años Antes
Hola. Discúlpame tú a mí. Entiendo perfectamente que si tienes más de 800 comentarios pendientes no puedas entretenerte demasiado en aprobarlos todos y mucho menos en un tiempo razonable. Aprovecho para darte ánimos con el blog, que sigo desde hace tiempo y me parece que es de lo mejorcito que hay por la red. Me consta que mucha gente relacionada de una u otra manera con la química, lee tus posts. Por algo será…
Saludos
Rubén Herrero, 9 Años Antes