¿Cambia una constante de equilibrio con la dilución?
Escrito por Quimitube el 18 mayo
Esta semana tuve que responder la consulta de una alumna en un vídeo de ácido base sobre qué ocurría con la constante de acidez cuando duplicamos el volumen de una disolución. Mi primera respuesta fue que no cambia, la constante permanece igual. Sin embargo, después, dándole vueltas al tema mientras iba conduciendo, tuve un cierto lapsus y me empecé a plantear si había respondido correctamente o si había inducido a error a esta alumna. Afortunadamente el lapsus duró un minuto y no me dediqué a buscar el comentario para rectificarlo porque le había respondido bien: la constante se mantiene, claro. Pero vamos a ver por qué no cambia la constante y por qué la pregunta puede dar lugar a error en un momento dado.
Consideremos una reacción que tiene lugar en disolución. Para la reacción:
aA(aq) + bB(aq) → cC(aq) + dD(aq)
La constante de equilibrio será:
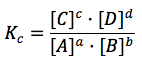
Si duplicamos el volumen de la disolución hay algo que sí que cambia: las concentraciones de las especies pasarán a ser la mitad. Sin embargo, la constante de equilibrio, como vemos en la fórmula, es una relación de concentraciones y depende del sistema químico y de la temperatura. Si cambian las concentraciones por dilución, el sistema evolucionará nuevamente para lograr alcanzar el valor de la constante de equilibrio en su relación de concentraciones. Es decir, las concentraciones sí pueden modificarse pero no así el valor de Kc. En la reacción indicada ni siquiera habría modificación del equilibrio porque todas las especies sufrirían exactamente la misma modificación en su concentración, es decir, se dividiría por 2, y al tener dos factores en el numerador y dos factores en el denominador, se simplificarían.
Si lo que tenemos es un ácido como puede ser el ácido acético, y en lugar de Kc consideramos la constante de acidez Ka (que incluye la concentración de agua), entonces el tema cambia porque no se simplifican, ya que tendremos dos factores en el numerador y solo uno en el denominador. Consideremos dicha reacción, la reacción ácido-base del ácido acético en agua:
CH3COOH(aq) + H2O(l) ↔ CH3COO–(aq) + H3O+(aq)
Su constante de acidez, Ka, vale 1,79·10-5 a 25 ºC. La expresión de Ka para esta reacción será:
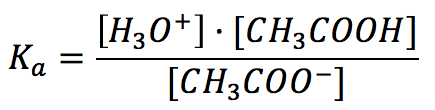
Si tenemos una disolución con una concentración inicial 1M de ácido acético, en el equilibrio tendremos las siguientes concentraciones:
[CH3COOH] = 0,996 M
[CH3COO–] = 4,22·10-3 M
[H3O+] = 4,22·10-3 M
(Puedes ver cómo se calcula esto en el ejercicio sobre el cálculo del pH de un ácido débil).
Si diluimos duplicando el volumen, entonces sus concentraciones serán la mitad:
[CH3COOH] = 0,498 M
[CH3COO–] = 2,11·10-3 M
[H3O+] = 2,11·10-3 M
Pero si sustituimos estos valores en la expresión de Ka, no obtenemos 1,79·10-5, sino 8,9·10-6. Esto es lo que podría llevarnos a pensar que la constante de acidez, y por ende la constante Kc de cualquier equilibrio químico, cambia con la dilución. ¡Craso error! No es Ka lo que ha cambiado, sino, Qa, el cociente de reacción. Precisamente no obtenemos el valor de la constante de acidez con la relación de concentraciones tras diluir porque, a causa de la dilución, el sistema ha dejado de estar en equilibrio. Una vez que se diluye, el sistema debe evolucionar nuevamente y modificar dichas concentraciones para alcanzar el equilibrio otra vez y, una vez logrado esto, entonces sí, la relación de las nuevas concentraciones volverá a darnos el valor de Ka, que no cambia siempre y cuando mantengamos la temperatura.
Así que si alguna vez os formulan esta pregunta: «¿Cambia el valor de una constante de equilibrio con la dilución?», no tengáis lapsus. No, no cambia. La constante de equilibrio se mantiene constante, que para algo es una bonita constante.





Hola! Gracias por la entrada y por todos los videos! Una observación sobre diluir un sistema en equilibrio teniendo en cuenta la constante Kc: si todo el sistema se diluye alcanzando la mitad de las concentraciones de cada especie, no necesariamente los factores «2» del numerador y del denominador van a simplificarse de modo que la relación permanece igual, ya que el 2 también está dentro de la potencia que sería el coeficiente estequiométrico. O sea:
Kc = (([C]/2)^c * ([D]/2)^d)/(([A]/2)^a * ([B]/2)^b)
A lo que voy es que dependiendo de los coeficientes estequiométricos, puede que los factores dos se simplifiquen o no y que por lo tanto el equilibrio se desplace o permanezca. Gracias por tantos videos y publicaciones tan interesantes!!!
Facundo, 9 Años Antes
Hola Facundo, otro lapsus más con esto, ¡estoy despistada! Tienes toda la razón, si los coeficientes estequiométricos son distintos también en la reacción genérica indicada se desplazará el equilibrio. Un saludo grande y mil gracias por tu comentario.
QuimiTube, 9 Años Antes
Mil gracias por toda la explicación. Estaba dudando muchísimo y no conseguía entenderlo hasta leerte.
Gracias de nuevo ?
Beatrice, 5 Años Antes
¡Muchas gracias a ti! 🙂
QuimiTube, 5 Años Antes