¿Existe el fuego valyrio?
Escrito por Quimitube el 10 junio
Seguramente muchos de vosotros habréis leído los libros de Canción de hielo y fuego, de George R.R. Martin, o habréis visto la serie Juego de tronos que se basa en ellos (Juego de tronos es el título del primer libro de la saga, del que ha tomado el título la serie completa). Uno de los episodios de la serie, el noveno de la segunda temporada, recreaba una batalla en el Aguasnegras, el río que hay en Desembarco del Rey, la capital de los siete reinos. Y en esta batalla, Tyrion Lannister consigue la victoria organizando un ataque a la flota enemiga, la de Stannis Baratheon, con un material ficticio llamado fuego valyrio del que está repleto un barco trampa atracado en la bahía. Este fuego es una sustancia pastosa e inestable de color verde brillante que se extiende con una facilidad pasmosa y es imposible de apagar, ardiendo incluso debajo del agua y consumiendo a aquellos a los que alcanza entre terrible sufrimiento.
Hay quien piensa que el fuego valyrio de Juego de tronos está inspirado en un material inflamable de composición hoy desconocida denominado fuego griego, y que también ayudó a ganar algunas batallas en la Antigüedad, como la defensa de Constantinopla frente a las flotas musulmanas en dos ocasiones. El hecho de que el fuego griego también pudiese continuar ardiendo incluso sobre la superficie del mar hace pensar en que su composición podría tener una base de compuesto orgánico insoluble, como nafta o petróleo crudo, pero, como decimos, no se conservan registros de la fórmula, pues los creadores se la llevaron con ellos a la tumba. También se especula con la presencia de óxido de calcio, CaO (cal viva) en la composición, dada su violenta reacción con el agua, que desprende gran cantidad de calor para producir cal apagada, el hidróxido de calcio, Ca(OH)2.
La cuestión es que, como decimos, tal vez el fuego valyrio de la serie podría estar inspirado en el fuego griego y otras armas incendiarias similares utilizadas a lo largo de la historia, pero no parece que su capacidad para quemar todo aquello que encontraban a su paso fuese tan impresionante como se representa en Juego de tronos.
No obstante, sí que hay una sustancia extremadamente inflamable y peligrosa, utilizada en las guerras modernas, que tal vez esté más cerca de la idea del fuego valyrio de lo que lo está el fuego griego: el fósforo blanco. Al menos, en lo que a consecuencias sobre los cuerpos humanos se refiere que, como veremos, son terroríficas.
El fósforo blanco es un alótropo común del fósforo puro. Por si no lo recordáis o lo desconocéis, los alótropos son distintas estructuras de un mismo elemento químico. Por ejemplo, el diamante y el grafito son alótropos o formas alotrópicas del carbono.
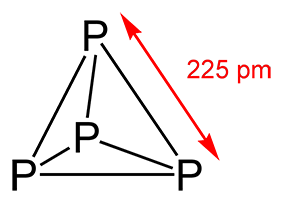
La fórmula del fósforo blanco es P4, es decir, se trata de cuatro átomos de fósforo unidos entre sí. Se unen formando un tetraedro en el que cada átomo ocupa uno de los vértices. El fósforo rojo, la otra forma alotrópica más habitual de fósforo, comparte la misma fórmula, si bien no comparten la misma estructura ni, por este motivo, las mismas propiedades. El fósforo rojo no es soluble en disulfuro de carbono ni es tóxico, características que el blanco sí que presenta.
La molécula tetraédrica de P4 está bastante tensionada, lo que hace que sea una estructura inestable. La inestabilidad es una cualidad de los compuestos químicos que se asocia frecuentemente con inflamabilidad, explosividad y otras formas de reacción rápida o violenta, dado que toda forma inestable en la naturaleza busca el modo de lograr una mayor estabilidad, y eso ocurre reaccionando.
Como decimos, se trata de una molécula tetraédrica, en la cual hallamos seis enlaces simples fósforo-fósforo.
A temperatura ambiente es un sólido pastoso de color blanco, como una cera, que rápidamente se oxida en su superficie para dar lugar a un color amarillento cuando se expone a la luz. En la oscuridad y en presencia de oxígeno brilla con un color verdoso. De hecho, de la palabra fósforo viene el término fosforescencia, que es una propiedad de las sustancias que son capaces de emitir fotones tiempo después de haber sido irradiadas con una radiación de una determinada longitud de onda.
El fósforo blanco es extremadamente inflamable y pirofórico (puede prender por sí solo) al contacto con el aire, así como tóxico, causando un severo daño hepático si se ingiere y fosfonecrosis por ingestión crónica o inhalación. Aunque de la fosfonecrosis hablaremos en una entrada posterior, cabe indicar que siglos atrás, cuando se empezó a producir fósforo en masa para aplicaciones industriales, muchos trabajadores del sector murieron de esta enfermedad o por las restantes propiedades de este elemento tan peligroso.
Es ligeramente soluble en agua y puede ser almacenado bajo ésta. De hecho, el fósforo blanco sólo está seguro de la autoignición cuando se sumerge en agua. Sí que es soluble en benceno, determinados aceites o disulfuro de carbono. Con este último, que también es bastante tóxico e inflamable, se puede combinar para potenciar las propiedades de peligrosidad de ambos.
Aunque la primera vez que se aisló el fósforo fue a partir de un engorroso procedimiento a partir de orina humana (creo que este punto también merece una entrada a parte), el alótropo blanco del fósforo puede ser producido en la actualidad utilizando distintos métodos. En el proceso industrial más utilizado, se calienta un mineral con un alto contenido en fosfato de calcio en un horno en presencia de carbono y de óxido de silicio(IV). El fósforo blanco se recoge como vapor y después se solidifica. La reacción es:
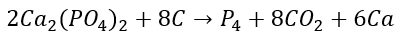
Es curioso, porque a pesar de ser un sólido, el fósforo blanco tiene una considerable presión de vapor a temperaturas normales.
La combustión espontánea del fósforo genera óxido de fósforo(V) según la siguiente reacción:
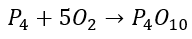
Para que os hagáis una idea de la toxicidad y la peligrosidad de este elemento, os pongo aquí su clasificación según la NFPA 704 (Sistema estándar para la identificación de los peligros de los materiales para la respuesta de emergencia de la Asociación Nacional de Protección contra Incendios de los EE. UU., que se usa prácticamente como un estándar internacional) que nos da su diamante del fuego:
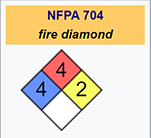
Las cuatro divisiones generalmente están codificadas por colores. El rojo, en la parte superior, indica inflamabilidad, azul, a la izquierda, indica el nivel de peligro para la salud, amarillo, a la derecha, para reactividad química, y blanco, abajo, contiene códigos para riesgos especiales. Cada uno de ellos se clasifica en una escala de 0 (peligro mínimo) a 4 (peligro severo).
El significado de este diamante del fuego para el caso concreto del fósforo blanco es el siguiente:
Rojo: inflamabilidad. Nivel 4: Se vaporizará rápida o completamente a la presión y temperatura atmosféricas normales, o se dispersará fácilmente en el aire y se quemará fácilmente. Incluye sustancias pirofóricas, como es el caso del fósforo blanco, que ya hemos comentado.
Azul: Efectos sobre la salud. Nivel 4: Una exposición muy corta podría causar la muerte o lesiones residuales importantes
Amarillo: inestabilidad-reactividad. Nivel 2: Sufre un cambio químico violento a temperaturas y presiones elevadas, reacciona violentamente con agua o puede formar mezclas explosivas con agua
Siguiendo con el símil del fuego valyrio, esta peligrosidad tan elevada hace que, de hecho, se use también como arma de guerra. En el mundillo militar se conoce como P4 o WP, por sus siglas en inglés (White Phosphorus).

Teóricamente solo sería legal su uso por sus características de inflamabilidad. Si se usa por sus características tóxicas entonces debería ser clasificado como arma química, en cuyo caso estaría prohibida. No obstante, existe controversia en cuanto a si debería ser clasificada o no como tal y, hoy por hoy, no lo está y su uso es legal en base a la legislación internacional.
Además de arder con una intensidad inusitada, también se usa por su capacidad para formar cortinas de humo (granadas de humo). Esto se debe a que, cuando el P4 arde en contacto con la atmósfera forma óxido de fósforo(V), que después se hidrata rápidamente debido a que es muy higroscópico, por lo que forma H3PO4 que da lugar a un aerosol muy espeso.
Se empezó a usar a principios del siglo XX, esencialmente en la Primera Guerra Mundial, que desde luego fue tristemente célebre por la aplicación de la química al exterminio de seres humanos.
Puesto que actualmente no se considera como un arma química, el fósforo blanco no está prohibido, pues no está incluido en la Convención sobre Armas Químicas de 1997. Por este motivo se ha usado en conflictos recientes, como Irak, Gaza o el este de Ucrania. Está prohibido, eso sí, su uso contra objetivos civiles o entornos civiles.
Las partículas incandescentes del fósforo blanco que se producen en la explosión inicial pueden producir profundas, extensas y dolorosas quemaduras de segundo y tercer grado. Además, estas quemaduras de fósforo conllevan una mortalidad mayor que otros tipos de quemaduras, debido a la absorción del fósforo en el cuerpo a través de las áreas alcanzadas, resultando dañados órganos internos como el corazón, el hígado o el riñón (¿¿y no está clasificada como arma química??).
Se trata de quemaduras realmente terribles, inhumanas, que no tiene dificultad para llegar hasta el hueso, ya que los fragmentos siguen ardiendo mientras tengan acceso al oxígeno.
Personalmente prefiero no poner aquí una imagen de las quemaduras que produce este elemento, dado que soy muy aprensiva con las heridas y con la sangre y ponerla sin previo aviso es un poco a traición. Si alguno de vosotros tiene interés en ver una imagen, por supuesto lo podéis encontrar en internet.
Como curiosidad y para acabar, documentándome para esta entrada me he enterado de que venden un licor español a base de güisqui de color verde (y creo que también en otros colores) que se bautizó como fuego valyrio. Igual a vosotros os parece noticia antigua, pero yo, que estoy en babia, pues me acabo de enterar.
Y ahora qué pensáis, después de leer esta entrada, ¿existe el fuego valyrio?
También te puede interesar:




