¿Qué otros compuestos presentan la estructura cristalina del cloruro de cesio?
Escrito por Quimitube el 11 marzo
En una entrada reciente, hablamos de compuestos iónicos que presentaban la estructura cristalina de la sal gema, es decir, la forma mineral habitual del cloruro sódico, NaCl. Siguiendo esta idea escribiremos una serie de entradas para analizar otras estructuras iónicas y qué compuestos las presentan. Otra de las estructuras representativas que se suelen considerar cuando se estudia el enlace iónico, es la del cloruro de cesio. El catión cesio es un catión bastante voluminoso, mucho más que el sodio (el Na+ tiene un radio de 95 pm y el Cs+ tiene un radio de 169 pm, casi el doble), lo que hace que las estructuras cristalinas que forma se modifiquen. Así, la estructura que vamos a describir para el CsCl es también la que encontramos en otras combinaciones del cesio con los halógenos, como el yoduro de cesio, CsI, o el bromuro de cesio, CsBr.
Otros cationes también voluminosos combinados con halógenos pueden dar lugar a esta misma estructura, pocompr ejemplo, es notable el cloruro de amonio, NH4Cl, que también la presenta (el catión amonio tiene un radio aproximado de 146 pm). Esta es la celda unidad para dicho compuesto, que, como podemos ver, es equivalente a la del CsCl que se muestra posteriormente:
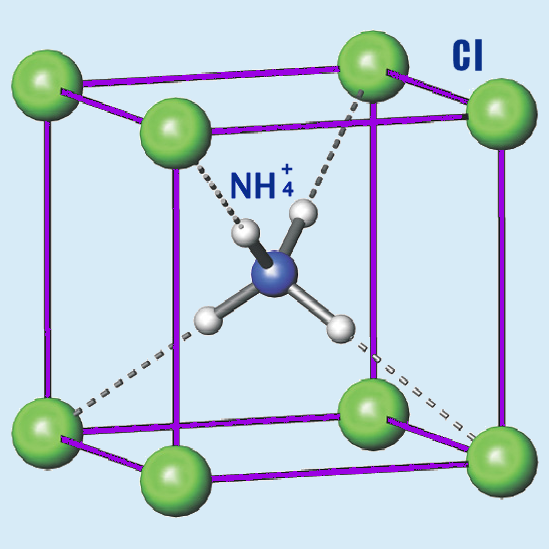
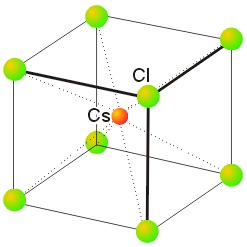
Conforme aumenta el radio iónico del ion M+, se pueden empaquetar más aniones a su alrededor, como se ve efectivamente si comparamos esta estructura, CsCl, con coordinación (8,8), con el NaCl, con coordinación (6,6).
La estructura del cloruro de cesio es mucho menos corriente que la estructura de la sal gema. En ella encontramos una celda cúbica en la que cada punto reticular está ocupado por un ion haluro y el catión metálico se sitúa en el centro de la celda (o viceversa). El número de coordinación de ambos tipos de iones es, como hemos indicado, 8, pues sus radios son tan semejantes que es posible esta forma de empaquetamiento (8,8), muy favorable energéticamente. Debemos puntualizar que, al contrario de lo que se indica en algunas ocasiones, la red del cloruro de cesio no es cúbica centrada, pues en la celda elemental del cloruro de cesio hay átomos diferentes en el centro de la celda y en sus vértices. La unidad asimétrica fundamental es el ion Cs+ junto con sus ocho vecinos Cl–.
Así, a continuación vemos las distintas estructuras de estos compuestos, en las que aparece en morado el catión cesio y en otro color el halógeno correspondiente.
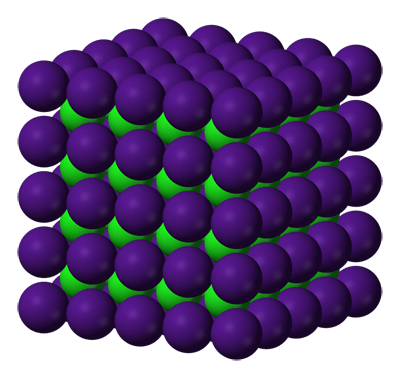
Estructura cristalina del propio cloruro de cesio. El cesio aparece en morado y el cloro en verde. Vemos que la coordinación es (8,8)
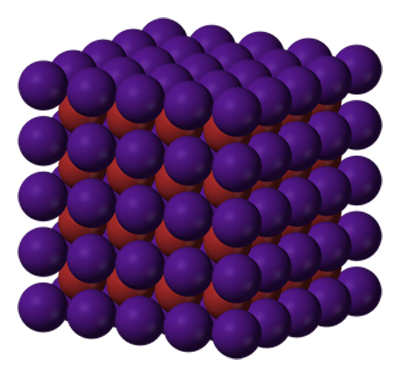
Estructura cristalina del bromuro de cesio. El cesio aparece en morado y el bromo en granate.
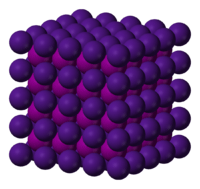
Estructura cristalina del yoduro de cesio. El cesio aparece en morado y el yodo en lila.
Fuente de las imágenes: Wikipedia. Dominio público.
También te puede interesar:
¿Qué otros compuestos iónicos presentan estructura cristalina de sal gema?
Modelos estructurales de compuestos iónicos




