Un ejercicio muy habitual del tema redox, dentro del temario de química de segundo de bachillerato y también de selectividad, es predecir si una reacción de oxidación reducción se va a producir. Por ello, aquí tienes un resumen de cómo proceder en estos casos.
De forma general, cuando evaluamos si una reacción química puede tener lugar, nos referimos a un aspecto termodinámico: concretamente, a la variación de energía libre de Gibbs entre reactivos y productos. Es en base a este parámetro que determinaremos si una reacción química es o no es espontánea. Podemos verlo gráficamente en el siguiente diagrama:
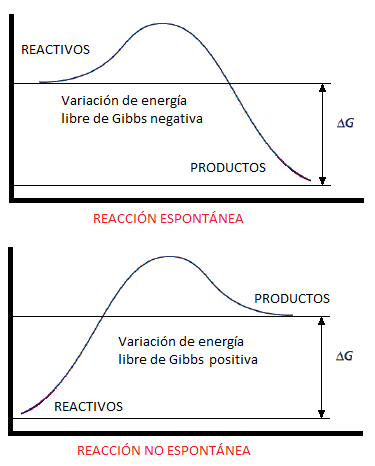
Así:
– Una variación de energía libre de Gibss negativa, implica un proceso espontáneo. Diremos que la reacción se produce.
– Una variación de energía libre de Gibbs positiva, implica un proceso no espontáneo. Diremos que la reacción no se produce.
Por tanto, como vemos, será la espontaneidad o no espontaneidad de la reacción, lo que determinará que el proceso se produzca o no se produzca.
De este modo, ¿cómo aplicamos esto a una reacción de oxidación reducción? Para aplicarlo a los procesos redox tendremos que calcular primero el potencial estándar de la reacción como si formásemos una pila galvánica hipotética con las dos semirreacciones; es muy sencillo. Los pasos serán:
1. Determinar las semirreacciones del proceso que queremos evaluar: la semirreacción de oxidación y la de reducción.
2. Determinar el proceso global.
3. Calcular el potencial estándar de la reacción igual que si formásemos una pila galvánica con ambas semirreacciones, recordando que la fórmula empleada es la siguiente:
![]()
Puesto que en el cátodo tiene lugar la semireacción de reducción y en el ánodo la de oxidación, se puede poner también de la siguiente forma:
![]()
4. Una vez que hemos calculado el potencial estándar de la reacción, Eo(reacción), lo relacionaremos con la variación de energía libre de Gibbs del proceso. Ambos valores están relacionados mediante una ecuación (la ecuación de Nernst), aunque para nuestro propósito es suficiente con saber que el potencial estándar de una reacción es directamente proporcional a la variación de energía libre cambiada de signo, es decir:
![]()
Por tanto, tendremos que:
– Si el potencial estándar de la reacción es positivo, la reacción es espontánea. El proceso global SÍ se produce.
– Si el potencial estándar de la reacción es negativo, la reacción es no espontánea. El proceso global NO se produce.
¡Y ya está!
Puedes ver un ejemplo concreto de resolución de este tipo de ejercicios en el siguiente enlace:
Ejercicio 30: espontaneidad de las reacciones redox. Predicción de si el cloro y el yodo son capaces de oxidar el Fe(II) a Fe(III)




