Un columpio de tamaño molecular: el tetrafluoruro de azufre
Escrito por Quimitube el 28 octubre
En el estudio de la química se da mucha importancia a la geometría de una molécula. No se trata de un capricho de los químicos, sino de una necesidad, ya que de la geometría molecular pueden depender propiedades tan importantes como los puntos de fusión y de ebullición, la solubilidad en distintos disolventes o incluso su reactividad o su toxicidad. Cuando tenemos moléculas con pocos átomos, para la predicción de la geometría se utiliza frecuentemente un método sencillo aunque de nombre un tanto ampuloso: Repulsión de los Pares Electrónicos de la Capa de Valencia (RPECV), que como veréis en el enlace previo, hemos explicado detalladamente en uno de los vídeos de teoría del tema de enlace químico.
Dicho método se basa en el número de pares de electrones que rodean al átomo central de la molécula, de forma que en función de dicho número, los pares electrónicos de distribuirán en torno a él de una u otra forma, como se aprecia en la tabla siguiente:
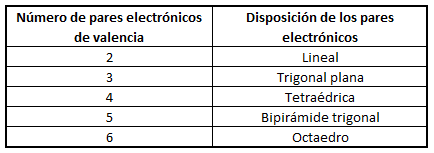
No siempre la geometría final de la molécula coincidirá con lo indicado en la tabla, ya que la presencia de pares de electrones libres (no enlazantes) modificará la disposición final de los enlaces, como ocurre en moléculas como el agua o el amoníaco.
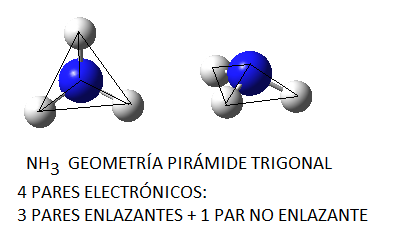
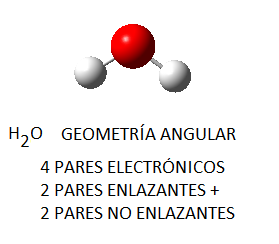
El amoníaco, NH3, en el cual el nitrógeno tiene 4 pares de electrones de valencia, uno no enlazante y tres enlazantes, tendrá geometría de pirámide trigonal, a pesar de que los pares electrónicos se dispondrán de forma tetraédrica por ser 4; del mismo modo, en el caso del agua, el oxígeno tendrá en torno a sí 4 pares electrónicos, 2 enlazantes y 2 no enlazantes, que se dispondrán tetraédricamente, pero la geometría final de la molécula de agua será angular.
El hecho de que la geometría final de la molécula dependa del total de pares electrónicos en torno al átomo central hace que en algunas ocasiones se den geometrías que pueden parecer un tanto “extravagantes”. Este es el caso de la molécula de tetrafluoruro de azufre, SF4, que presenta una geometría que recibe el nombre común de “silla de montar” o de “balancín”.
La estructura de Lewis para esta molécula es:
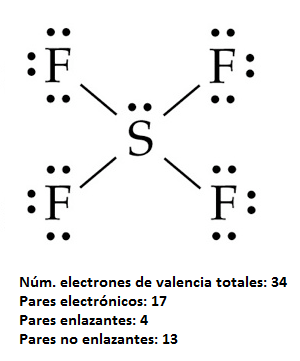
El átomo de azufre puede rodearse de más de 8 electrones en torno a él (en este caso 10) porque al tratarse de un átomo del tercer período tiene orbitales d energéticamente accesibles para ocupar.
Por tanto, el azufre central se rodea de 5 pares electrónicos, 4 enlazantes para los enlaces S-F y un par libre que va a distorsionar la estructura final. Cuando tenemos 5 pares electrónicos en torno al átomo central, la distribución de los mismos es la de una bipirámide trigonal. Si se tratase de cinco pares enlazantes, como en el caso, por ejemplo, del PCl5, tendríamos la siguiente geometría:
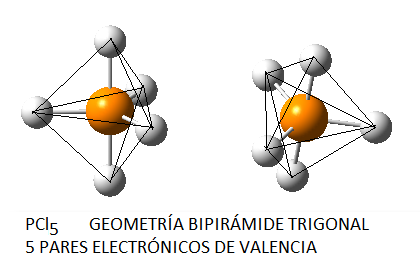
Sin embargo, en el caso del SF4, uno de estos enlaces estará sustituido por un par libre, por lo que la geometría final de dicha molécula queda como vemos a continuación con distintas perspectivas:
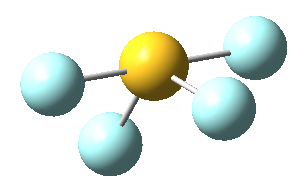
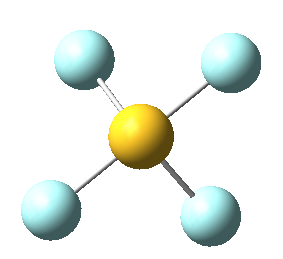
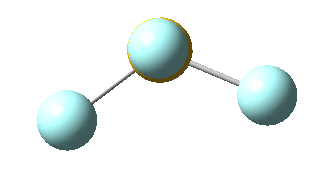
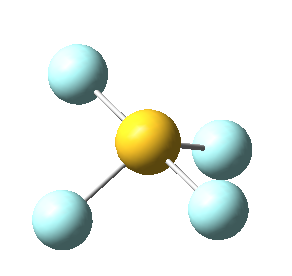
No obstante, cabe destacar que el ángulo F-S-F que aquí se observa de 180º es ligeramente menor (173,1º), ya que la repulsión electrónica entre el par libre del azufre y los pares de los enlaces azufre-flúor es mayor que la repulsión entre dos pares enlazantes, lo que hace que el ángulo se cierre ligeramente (recordemos que esto es también la causa de que los ángulos del amoníaco y del agua sean distintos de los 109,5º propios de un tetraedro perfecto).
En concreto, a continuación vemos los ángulos y distancias exactas de los enlaces del tetrafluoruro de azufre:
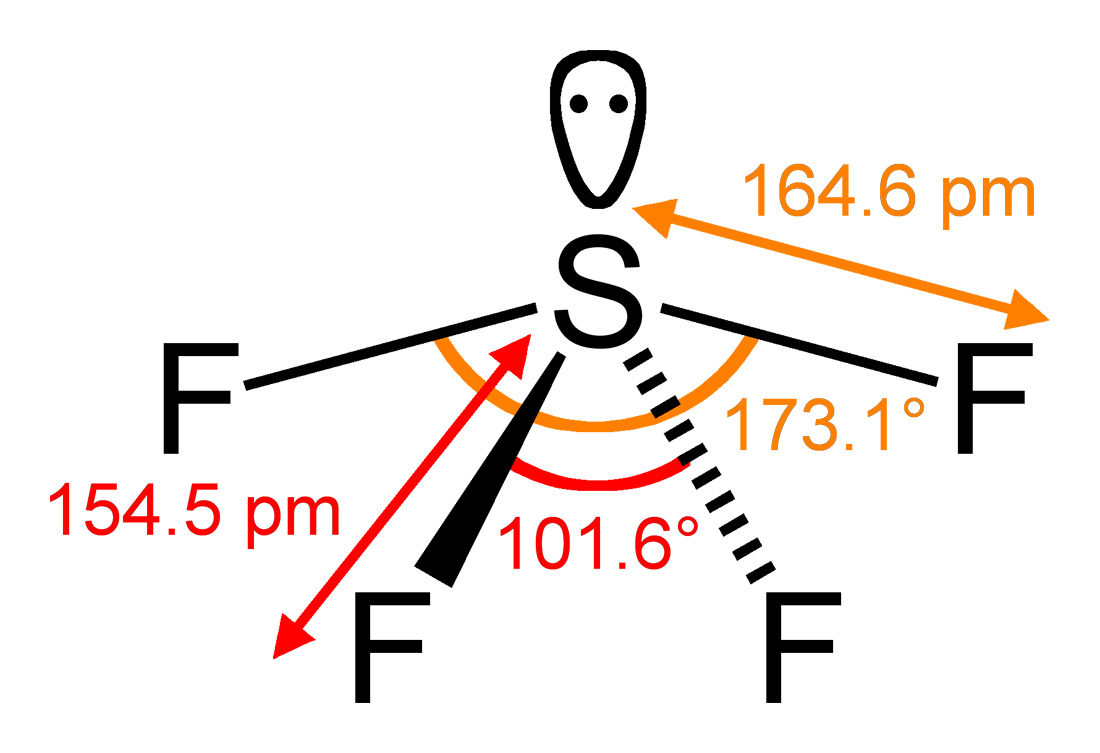
Esta geometría condiciona el hecho de que la molécula no sea apolar, como por el contrario ocurriría con una molécula similar, el hexafluoruro de azufre, SF6. En el SF4 los momentos dipolares de los 4 enlaces S-F no se anularán plenamente entre sí, sino que se sumará una de sus componentes. Esto hace, por ejemplo, que el punto de ebullición del SF4 (-38ºC) sea superior al punto de ebullición del SF6 (-64ºC), porque también serán mayores sus fuerzas intermoleculares y se requerirá mayor energía (mayor temperatura) para separar unas moléculas de otras y vaporizar el compuesto.
También te puede interesar:
Parámetros moleculares: energía de enlace, longitud de enlace y ángulo de enlace
Polaridad de enlace y polaridad molecular
Ejercicios de determinación de las estructuras de Lewis de diversas moléculas
Ejercicio de determinación de la geometría de diversas moléculas por RPECV





[…] Algunas moléculas presentan geometrías curiosas, como el tetrafluoruro de azufre, cuya estructura es la llamada silla de montar o balancín. […]
Un columpio de tamaño molecular: el tetr..., 12 Años Antes
Hola que tal me ha parecido interesante y la vez practica esta pagina, les agradezco. Pero queria preguntarles que otras areas de la quimica manejan o si podrian incluir otras como Q. Organica, algo de Q. analitica.
Gracias
Yarithza, 12 Años Antes