Larga vida a los antioxidantes: breve introducción a los radicales libres
Escrito por Quimitube el 20 diciembre
Seguro que habéis oído hablar con mucha frecuencia de radicales libres, especialmente en los anuncios de cosméticos, donde los hacen responsables de gran parte de las arrugas que surcan nuestra piel. Sí que es cierto que los radicales libres están implicados en procesos de envejecimiento y otros muchos (como multitud de complicaciones asociadas a la diabetes) pero es bastante probable que la mejor forma de combatirlos no sea a través de cremas carísimas, sino con la ingesta de antioxidantes como las vitaminas E, C y el grupo de las B que, de hecho, aparecen en menor concentración en individuos diabéticos que en individuos sanos.
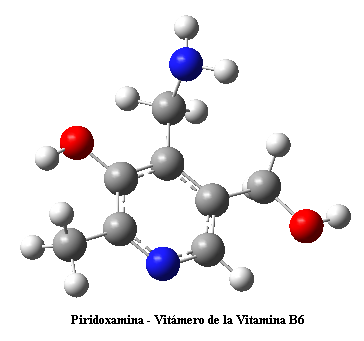
En realidad, los radicales libres están implicados en muchas reacciones bioquímicas esenciales y son totalmente normales. Por ejemplo, la respiración oxidativa que ocurre en las mitocondrias para aportarnos energía transcurre a través de radicales libres de oxígeno, y estos radicales no nos hacen daño, porque tal y como se generan, se consumen en pasos posteriores. El problema es cuando un estado patológico se asocia a un aumento descontrolado de los radicales libres. Ahí sí que tenemos un problema; como cualquier patología, se trata de un desequilibrio metabólico entre lo que se produce y lo que se consume.
Pero… ¿qué es un radical libre, a parte de ser el cabeza de turco de todas las cremas antiarrugas? Pues es una especie química que tiene un átomo con un electrón desapareado. Ya hemos visto en el tema de enlace covalente que siempre que planteamos una estructura de Lewis colocamos los electrones por pares, tanto enlazantes como libres. El motivo de esta colocación es que las moléculas con todos sus electrones apareados son mucho más estables (tienen menos energía). Por ejemplo, consideremos el peróxido de hidrógeno, H2O2 (H-O-O-H), y la molécula resultado de quitarle un átomo de hidrógeno, que será el radical hidroperoxilo, ·OOH (el puntito simboliza el electrón desapareado, aunque en el dibujo no aparecen los electrones y, por tanto, no se puede visualizar):
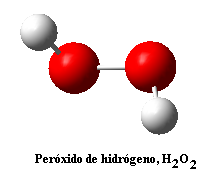
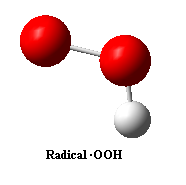
Cabe destacar que el H2O2 no se ha desprotonado, es decir, no ha perdido un protón o átomo de hidrógeno con carga positiva, H+, sino que ha perdido un átomo de hidrógeno completo, neutro, con su protón y su electrón correspondientes. Por este motivo el radical ·OOH sigue siendo neutro, no tiene una carga negativa neta, sólo tiene un electrón sin pareja (está muy solo, el pobre) pero no tiene ningún electrón en exceso con respecto al número total de protones. Por ejemplo, este radical tendrá:
- 2 oxígenos, con 8 protones y 8 electrones cada uno
- 1 hidrógeno, con 1 protón y 1 electrón
En total, la especie química tendrá el mismo número de protones y de electrones y por tanto su carga neta es cero; pero hay un electrón que se siente solo, muy solo, y busca compañía desesperadamente.
Puesto que las especies con los electrones apareados son más estables, los radicales libres son extremadamente inestables. La inestabilidad, en química, se asocia con la reactividad: un radical libre reaccionará con facilidad con multitud de cosas que encuentre a su paso con tal de estabilizarse para convertirse en una especie no radicalaria.
Así, en el organismo, puede dañar multitud de macromoléculas, en especial lípidos y proteínas. Pero el problema no acaba aquí, y esa es la causa de que sean tan dañinos: cuando un radical actúa sobre una molécula convierte a esa molécula en un nuevo radical, y así la cadena de reacciones se autocataliza (o se autoabastece) hasta que dos radicales libres reaccionen entre sí para neutralizarse. Hasta que eso ocurre, un solo radical puede haber iniciado y propagado un daño bastante considerable.
Por ejemplo, supongamos que un radical X· actúa arrancando un hidrógeno de una molécula RH. Lo que ocurrirá será:
X· + RH –> XH + R·
, generándose un radical R· de la molécula inicial RH, capaz de continuar reaccionando con otras especies como buen radical que es.
Y el daño infringido puede abarcar las membranas plasmáticas, proteínas de larga vida como el colágeno (sí, el que mantiene firme la piel y aporta consistencia a nuestro órganos y estructuras, como riñones o vasos sanguíneos) o la mielina (tan importante en nuestro sistema nervioso).
Pero si el radical encuentra por el camino una molécula RH con mayor capacidad para reaccionar con él que nuestras macromoléculas, como un antioxidante, entonces reaccionará antes con dicho antioxidante. Después, cuando dos moléculas radicalarias de antioxidante se encuentren, pueden formar un dímero neutro y no radicalario, es decir:
2R· –> R-R
Que, como veis, ya no tiene ningún electrón desapareado y por tanto la cadena de reacciones radicalarias habrá quedado, ¡al fin!, frenada.
Así que ya sabéis, a tomar muchas vitaminas (y poca azúcar, pero eso será otra entrada) que seguramente será la mejor forma de mantener la piel tersa y también otras muchas más cosas tersas y sanas bastante más importantes que la piel.





Algunas pinturas pierden color por los radicales, ¿no?
ununcuadio, 13 Años Antes
¡Hola! La verdad es que lo desconozco, tendremos que unir nuestros esfuerzos químicos para averiguarlo 😀
Quimitube, 13 Años Antes
Ok 🙂
Ununcuadio, 13 Años Antes
Hola! Mira lo que ha publicado @Scientia en Naukas: http://naukas.com/2012/12/21/el-reglamento-europeo-que-ha-acabo-con-la-idi-de-la-industria-alimentaria/ ;D
Ununcuadio, 13 Años Antes
Fenomenal, ya me lo he leído de cabo a rabo 😀
Quimitube, 13 Años Antes
Información Bitacoras.com…
Valora en Bitacoras.com: Seguro que habéis oído hablar con mucha frecuencia de radicales libres, especialmente en los anuncios de cosméticos, donde los hacen responsables de gran parte de las arrugas que surcan nuestra piel. Sí que es cierto que los …..
Bitacoras.com, 13 Años Antes
Caramba con el artículo sobre los radicales libres. Me has dejado de piedra al saber que los diabéticos sufrimos mas deterioro por su causa, asi que a atiborrarme de vitaminas del grupo B aparte de mas fruta y verduras.
Me ha hecho mucha gracia tu ultimo comentario sobre lo de mantener la piel tersa y otras muchas más cosas…….tersas….
Wind, 13 Años Antes
Pues sí, pero no te preocupes porque es en caso de diabetes mal controlada o no diagnosticada. Si sigues un tratamiento, en realidad estás paliando en gran medida los efectos del exceso de glucosa en sangre y los radicales que esto produce.
QuimiTube, 13 Años Antes