¿Qué otros sólidos iónicos tienen estructura de sal gema?
Escrito por Quimitube el 17 enero
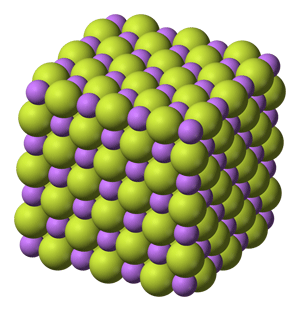
Cuando por primera vez explicamos (o nos explican) el enlace iónico a nivel escolar, es muy frecuente utilizar como ejemplo el cloruro sódico, NaCl, para este menester. Imagino que los motivos son varios: es un compuesto de uso habitual en todos los hogares, los iones son monovalentes (lo que facilita relacionar la estequiometría del compuesto con los electrones ganados y perdidos para formar Na+ y Cl–) y además su estructura cristalina es sencillas. Así, la llamada estructura de sal gema (la forma mineral más habitual del cloruro sódico) se basa en una disposición ccc (cúbica centrada en las caras) de los cloruros, que son más voluminosos, y en la que los cationes ocupan los huecos octaédricos formados. Alternativamente, también se puede ver como una estructura en la que los aniones ocupan todos los huecos octaédricos de una disposición ccc de los cationes Na+. Cada ion está rodeado por un octaedro de seis iones de signo contrario, de modo que el número de coordinación de cada ion es 6 y podemos escribir que se trata de una estructura de coordinación (6,6). Esta es la estructura:
Estructura cristalina de la sal gema. Se observan los octaedros que rodean a cada tipo de ion con iones de signo contrario.
Los seis vecinos inmediatos del ion central de la celda están en los centros de las caras de la misma, mientras que los doce vecinos siguientes del ion central, los que se encuentran inmediatamente más separados (y tienen la misma carga que el ion central) se encuentran en el centro de cada una de las aristas.
Ahora bien, una vez descrita esta estructura que tomamos siempre como ejemplo, cabe preguntarse: ¿es una estructura frecuente? ¿Encontramos otros compuestos iónicos que adopten esta misma disposición de los cationes y los aniones en la celda unidad? Pues la respuesta es que sí: se trata de una estructura muy frecuente, la más frecuente, de hecho, en comparación con otras estructuras iónicas (antifluorita, fluorita, cloruro de cesio, arseniuro de níquel, perovsquita, rutilo…). Muchos compuestos iónicos con la misma estequiometría que el cloruro sódico, AX (siendo A el catión y X el anión), tanto con iones monovalentes como divalentes.
Compuestos con estructura de sal gema de iones monovalentes
Dentro de este grupo hallamos compuestos como la combinación de los metales alcalinos con los halógenos. Así, tenemos no solo el cloruro sódico, NaCl, ya indicado y tomado como ejemplo, sino también el fluoruro sódico, NaF, o el yoduro sódico, NaI. Otros ejemplos son el cloruro de litio, LiCl, el bromuro de litio, LiBr, o el fluoruro de litio, LiF. Del mismo modo, tenemos otros como las combinaciones del potasio con los halógenos: bromuro de potasio, KBr, cloruro de potasio, KCl, y fluoruro de potasio. Pero no solo tenemos estos ejemplos, sino que hay más, especialmente en las combinaciones de halógenos, en general, con muchos otros cationes, como el yoduro de rubidio, RbI, el cloruro de plata, AgCl, o el bromuro de plata, AgBr.
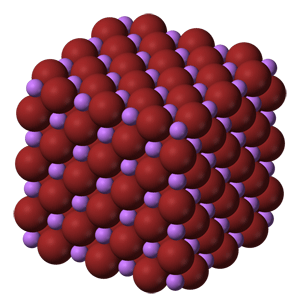
Estructura química del bromuro de litio. Los cationes litio aparecen en lila y los aniones bromuro en granate. Se puede observar que los litios se hallan en el centro de las caras tomando una celda unidad.
Estructura química del fluoruro de litio. Se puede observar que la disposición de los cationes litio y de los aniones fluoruro es idéntica al caso anterior, aunque la relación de tamaño Anión/Catión es menor porque el radio del fluoruro es menor que el del bromuro.
La combinación del sodio con otros halógenos también presenta la misma estructura, por ejemplo el yoduro sódico, NaI
Compuestos con estructura de sal gema de iones divalentes
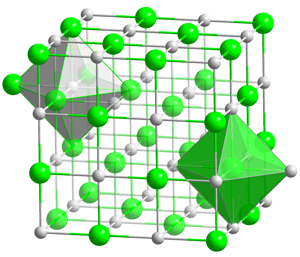
Dentro de este otro grupo hallamos compuestos formados por combinación del oxígeno con cationes divalentes, por ejemplo los alcalinotérreos: óxido de magnesio, MgO, el óxido de calcio, CaO (también el CaS) y óxido de estroncio, SrO. También hallamos en este grupo el óxido de titanio (II), TiO, o los óxidos de hierro (II) y de níquel (II), FeO y NiO.
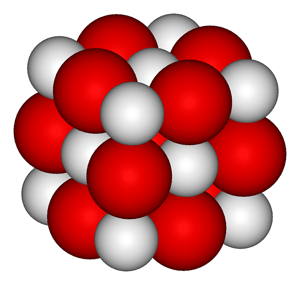
Estructura química del óxido de calcio, CaO. En rojo se observa el oxígeno y en blanco el calcio, que tiene un radio iónico menor.
Otros compuestos con estructura de sal gema
Existen otros compuestos iónicos menos frecuentes que los indicados que presentan también esta estructura química. Por ejemplo, dentro de este grupo hallamos algunos nitruros (formados por combinación de un catión con el anión nitruro, N3-, isoelectrónico con O2- y F–), como el nitruro de titanio, TiN, y el nitruro de escandio, ScN. Incluso hallamos también dentro de este grupo el carburo de uranio de fórmula UC.
También te puede interesar: