¿Se puede convertir el grafito en diamante?
Escrito por Quimitube el 19 enero
En una entrada reciente hablábamos de un experimento en el que Moissan intentó fabricar diamante artificial en el laboratorio y que, aunque él afirmó haberlo logrado en una conferencia que dio en 1896, pudo ser una broma pesada ya que jamás se logró reproducir el experimento. Pero eso ocurrió hace más de un siglo, de modo que cabe preguntarse si hoy en día es posible fabricar un diamante a partir de materiales más corrientes y baratos, como el grafito. El diamante es un material con una gran utilización a nivel industrial dada su gran dureza, además de tratarse, como sabemos, de un objeto de lujo.

Esta es, probablemente, la imagen que nos viene a la mente cuando pensamos en un diamante. A nivel industrial su apariencia es muy distinta pero es igualmente valioso.
El diamante y el grafito presentan una característica común esencial: ambos compuestos son carbono puro, es decir, átomos de carbono unidos entre sí, y nada más. La diferencia entre un compuesto que compramos en cualquier papelería a un precio, como quien dice, irrisorio, y el diamante que se vende a un precio desorbitado, no es más que la forma en la que esos átomos se unen; se dice que son dos formas alotrópicas de un mismo elemento. La estructura de los dos compuestos es distinta, y eso hace que sus propiedades macroscópicas y su precio sean del todo distintos.
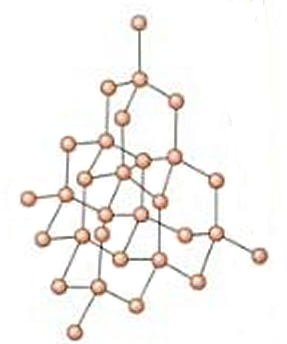
En el diamante, cada átomo de carbono se halla unido a otros cuatro átomos de carbono con enlaces simples y en disposición tetraédrica (ángulos en torno a los 109º). Esto da lugar a una estructura cristalina perfecta que se va repitiendo en las tres dimensiones del espacio, como se puede apreciar en la siguiente imagen:
En cambio, en el grafito, lo que encontramos son capas planas de átomos superpuestas entre sí. Cada átomo de carbono se une únicamente a otros tres átomos en cada capa con ángulos de 120º, mientras que después las capas están unidas entre sí por fuerzas más débiles.
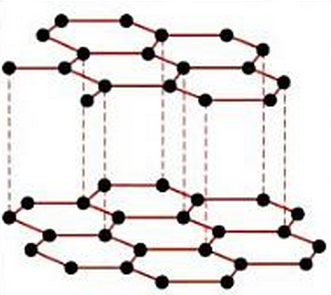
El grafito está formado también por carbono puro pero los átomos se disponen formando capas planas apiladas
Por tanto, como vemos al comparar ambas estructuras, si fuésemos capaces de lograr que los átomos de carbono del grafito rompan sus enlaces y se dispongan de forma tetraédrica, habríamos logrado el milagro alquímico de transformar una simple mina de lápiz en un diamante. El equilibrio de este proceso será:
C (grafito) ↔ C (diamante)
Se trata de un proceso termodinámicamente desfavorable, ya que la forma de grafito es químicamente más estable que la forma de diamante; la reacción es endotérmica. Asimismo, el diamante es más denso que el grafito (3,5 g/cm3 frente a una densidad que varía entre 2,09 y 2,23 g/cm3). Según el principio de Le Châtelier, un aumento de la temperatura favorecerá la reacción endotérmica, hacia la derecha, y en el mismo sentido actuará un aumento de la presión. Así, es efectivamente posible hoy en día lograr la transformación de grafito en diamante utilizando temperaturas muy muy elevadas, del orden de 2000ºC, y presiones brutales, del orden de 50.000 a 150.000 atm (el equivalente a tener encima una columna de entre 516 y 1548 kilómetros de agua, cuando la profundidad máxima del océano es de 11 km). Ahora bien, con este proceso, tristemente, no obtendremos la impresionante piedra preciosa que hemos compartido antes, sino únicamente un material de uso industrial valioso por su dureza y que sirve para cortar, pulir o triturar y también para sensores electroquímicos.
Como podéis imaginar, un proceso industrial capaz de alcanzar semejantes temperatura y presión es muy muy caro. Sin embargo, en el año 2013, por casualidad, un grupo de investigación de la Universidad de Stanford que estaba investigando formas de sustituir el silicio en transistores, descubrió un método de transformación del grafito en diamante que no requiere estas presiones. La clave está en unir una cantidad pequeña de capas de grafito sobre un sustrato de platino y proceder a la hidrogenación.
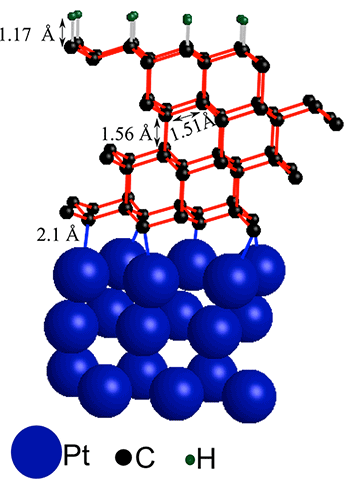
La unión de una pequeña cantidad de capas de grafito a una superficie de platino y la posterior hidrogenación hace que adopten estructura de diamante. Fuente: Sarp Kaya y Frank Abild Pedersen / SUNCAT
Este proceso inicia una reacción en cadena en la que estas capas de grafito empiezan a adoptar la estructura tetraédrica del diamante desde la capa superficial hacia las capas internas, quedando una fina capa de diamante unido al platino que puede tener también potenciales aplicaciones industriales. Según los propios investigadores, esto podría ser el descubrimiento de una nueva ruta para lograr la conversión del grafito en diamante en unas condiciones algo más amables.




