Contenido del Vídeo
Hemos visto en el vídeo Termodinámica Teoría 20: Concepto de energía libre de Gibbs que el criterio de espontaneidad y no espontaneidad de una reacción química a partir de ΔG es el siguiente:
| ΔG > 0 | No espontánea |
| ΔG = 0 | Equilibrio |
| ΔG < 0 | Espontánea |
Por tanto, conociendo el valor de ΔG, o simplemente su signo, podemos determinar si la reacción dada es o no espontánea. Ahora bien, ¿cómo podemos llegar al valor de ΔGro? Pues tenemos diferentes opciones, y usaremos una u otra en función de los datos de los que dispongamos.
- Con la fórmula que relaciona H y S (ΔG = ΔH – TΔS (visto en el apartado Termodinámica Teoría 20: Concepto de energía libre de Gibbs))
- De forma cualitativa: solo se determina el signo de ΔG disponiendo de los signos de ΔH y ΔS
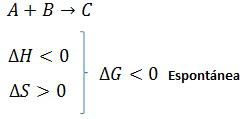
- De forma cuantitativa: calcular directamente ΔG si disponemos de ΔH, ΔS y T, por ejemplo: siT = 325ºCΔH = -238,5 kJ/molΔS = ±230,1 J/K·mol (hay que pasar los J a kJ)
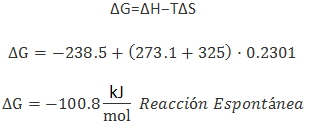
- De forma cualitativa: solo se determina el signo de ΔG disponiendo de los signos de ΔH y ΔS
Con la expresión de productos-reactivos, es decir, a partir de las energías libres de formación ( visto en el apartado Termodinámica Teoría 21: Energías libres de Gibbs de formación y de reacción)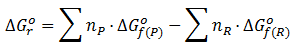

Te puede interesar:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola. Tengo una pregunta, ¿Si se calcula la energía libre de Gibbs de una reacción con la formula que involucra entalpía y entropía, el valor obtenido debería ser el mismo para la misma reacción si ahora se usa la formula de energía libre de Gibbs de formación estándar?
Carlos Reyes, 12 Años Antes
¡Hola! Sí, debe darte lo mismo dado que estás calculando exactamente el mismo parámetro. Ahora bien, en ocasiones no se tienen en cuenta las variaciones de DH y DS con la temperatura y es posible que te dé resultados ligeramente distintos si no te aportan en el enunciado los datos precisos. Un saludo.
QuimiTube, 12 Años Antes
Buenas tardes: En el caso dos, sumas la temperatura en K y en ºC, y no sé por qué se hace: (273,15 + 325) Gracias.
Elena, 12 Años Antes
¡Hola Elena! Es la forma de convertir los grados centígrados en Kelvin, sumarle 273,15 (siempre es igual). Se hace esto porque la temperatura en el resto de magnitudes aparece en kelvin, y entonces tenemos que tenerla en kelvin en todas las operaciones, porque no podemos mezclar distintas unidades. Un saludo.
QuimiTube, 12 Años Antes
Genia!!! gracias, pasado mañana rindo un coloquio asi la promociono a quimica! gracias!
Facundo, 12 Años Antes
Mucha suerte, ¡que te vaya muy bien!
QuimiTube, 12 Años Antes
Haces un gran trabajo y explicas muy bien. Estaba muy perdida con este tema y ya me he puesto al día. Un saludo desde Puente Genil (Córdoba)
ALICIA, 12 Años Antes
¡Hola Alicia! Muchas gracias, me alegra mucho que te sirva y que te hayas podido poner al día, verás como la termoquímica es hacer muchos ejercicios pero luego no resulta tan compleja como parece al principio. Un abrazo desde Mallorca.
QuimiTube, 12 Años Antes
Primeramente darte las gracias por explicarlo de una manera tan didáctica, clara y completa. Realmente es un placer escuchar tus clases. Mi pregunta es la siguente. Hasta cuando extendereis el temario de termoquímica? Por decirlo de alguna manera, que nos queda por dar? Muchas gracias por todo.
Andrés, 11 Años Antes
¡Hola Andrés! Muchas gracias por tu comentario. Puesto que de momento nos centramos en 2º de bachillerato y posteriormente iremos a niveles inferiores, no tenemos intención (al menos en los próximos meses) de ampliar el temario de termoquímica. Quizá cuando finalicemos el resto de contenidos podamos plantearnos agregar nuevos vídeos de nivel universitario. Un saludo grande.
QuimiTube, 11 Años Antes
Es plausible la vocación que tiene para dar clase y la felicito por ello. Aprovecho la ocasión también para agradecer enormemente por toda la ayuda que han representado sus videos para el refuerzo de mi aprendizaje. Tenía también una duda y es: al momento de determinar cualitativamente el signo de la energia libre de gibbs, un hipotético caso en el cual se tenga una T<0 no alteraría el signo de dicha energía libre? Muchas gracias de antemano por considerar mi comentario y buenas noches.
alejandro, 10 Años Antes
ya me di cuenta de que la temperatura siempre va a ser positiva porque se trabaja con grados kelvin, igualmente muchas gracias
alejandro, 10 Años Antes
¡Hola! Ten en cuenta que la fórmula es:
DG = DH – TDS
Si tú considerases hipotéticamente la temperatura como negativa, ese signo te tiene que afectar al factor -TDS, por tanto sí que la alteraría.
De todos modos nos movemos solo dentro de la suposición meramente matemática porque la temperatura negativa no es posible (hablamos de grados kelvin, temperatura absoluta).
Gracias por tu comentario, me alegro que te sirvan los materiales para tu aprendizaje. Un saludo grande.
QuimiTube, 10 Años Antes
Gracias por esta pagina quimitube, de verdad que me ha ayudado
Sois grandes
Sebastian, 10 Años Antes
¡Muchas gracias Sebastián! Un saludo.
QuimiTube, 9 Años Antes
Excelente. En todo sentido. Muy completo y de muy buen nivel.!
Muchas gracias.
Me gustaría que me envien algun nuevo material.
Sam, 5 Años Antes
Hola Sam, gracias por tu comentario, no disponemos de material adicional pero si miras todo el temario de termoquímica está muy completo y también hay ejercicios resueltos. Un saludo.
QuimiTube, 5 Años Antes
Consulta, como varia la energia de gibbs para una ionizacion de un acido debil y un acido fuerte
?
Melisa, 5 Años Antes
Hola Melisa, no entiendo bien la pregunta, ¿es así de genérica? Deberíamos fijarnos en datos más concretos de cada reacción en particular. En general para los ácidos fuertes la energía libre de Gibbs será negativa, dado que se disocian de forma espontánea, pero esto no significa que no pueda serlo también en los débiles. Como te digo, es muy genérica la pregunta.
QuimiTube, 5 Años Antes