Contenido del Vídeo
Aunque en la mayor parte del tema de termoquímica vamos a considerar las transferencias o variaciones de energía calorífica de una reacción química, en este apartado vamos a hablar de otro modo distinto de variación de energía, que es el trabajo mecánico de cambio de volumen (expansión o compresión) de un gas, ya que este concepto volverá a aparecer cuando hablemos del Primer Principio de la Termodinámica (apartado 5), que es parte esencial de este tema.
¿Qué es el trabajo de compresión o expansión de un gas?
El trabajo de cambio de volumen de un gas es el trabajo necesario para que el gas pase de un volumen inicial Vi a un volumen final Vf. Si el volumen disminuye, el gas se habrá comprimido y hablaremos de trabajo de compresión; si el volumen aumenta, el gas se habrá expandido y hablaremos de trabajo de expansión.
Para ilustrar mejor este trabajo de expansión o compresión de un gas, imaginemos un gas cerrado dentro de un recipiente, una de cuyas paredes es un émbolo móvil (como el de una jeringa) pero sin masa ni rozamiento. Si se produce una variación del volumen del recipiente, el émbolo se desplazará una distancia Δx, ya que en su expansión el gas empuja el pistón contra la presión externa, que permanece constante.
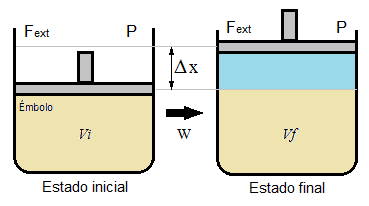
Puesto que el trabajo es es fuerza por desplazamiento, podemos escribir que:
W = -Fext·Δx
Y la fuerza es presión·superficie: Fext = P·S
W = -P·S·Δx
Mientras que la superficie por la variación de x que sufre el émbolo es la variación de volumen que experimenta el recipiente:
S·Δx = ΔV
De modo que finalmente el trabajo de expansión es:
![]()
Criterio de signos en el trabajo de compresión y expansión de un gas
Si aumenta el volumen, es el gas, es decir, el sistema, el que realiza un trabajo mecánico. Según el criterio de signo que adoptaremos, que es el establecido por la IUPAC, este trabajo realizado por el sistema se considera de signo negativo, es decir, W < 0.
Si disminuye el volumen, es el entorno el que ejerce un trabajo sobre el sistema, en cuyo caso, según el criterio de signos establecido por la IUPAC, consideraremos que le trabajo es positivo, W > 0.
NOTA: Es posible que en algunos textos se halle un criterio de signos distinto a este para el trabajo, considerándose que W = +P·ΔV y que por tanto W > 0 para el trabajo realizado por el sistema y W < 0 para le trabajo realizado sobre el sistema. Esto es habitual en tratados de física y de ingenierías, aunque para química lo más habitual es considerar el criterio de signos expuesto aquí, que es el establecido por la IUPAC.
Ejemplo numérico simple de cálculo del trabajo de expansión de un gas
A continuación vamos a realizar un ejercicio numérico muy sencillo sobre el trabajo de expansión de un gas. El enunciado es:
Un gas se expande de un volumen inicial de 4 litros a un volumen de 9 litros, contra una presión externa constante de 2 atmósferas. Calcular el trabajo realizado por el sistema.
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Pensaba que era una exageración pero es verdad, es mejor seguir los vídeos en la página que sólo desde YouTube 🙂 directo a la barra de marcadores
Alai, 12 Años Antes
¡Hola Alai! Me alegro de que te haya servido la recomendación, ya que hacemos el trabajo de escribir los textos de pie de página para mejorar la explicación lo mejor es que los aproveches 🙂 Además yo creo que es más sencillo seguir así el orden. Ánimo con la carrera de física, que no es nada fácil!
QuimiTube, 12 Años Antes
hay algo q no entiendo porque yo el trabajo lo vi como una integral auxilio D:
Brian, 12 Años Antes
Hola Brian, normalmente la mayoría de fórmulas son en forma de diferenciales e integrales, lo que ocurre es que muchas veces se simplifica para casos concretos. Supongo que tú lo viste así a nivel universitario, esto es para nivel preuniversitario.
QuimiTube, 12 Años Antes
o sea se toma la expansion o compresion de un gas como si fuese una funcion de 1/x y la formula me termina quedando
w = – nRT ln(Vfinal/Vinicial) osea seria lo mismo usar las otras formulas?
Brian, 12 Años Antes
muy pronto le haré unas preguntas sobre si realmente explica bien la entropia la 2da ley de la termodinámica o el big ban, cosa que da risa.
armando, 12 Años Antes
Hola Armando, no tengo conocimientos sobre las aplicaciones del segundo principio de la termodinámica al Big bang, no es mi campo, esto estaría más bien orientado al campo de la física, lo lamento. Un saludo.
QuimiTube, 12 Años Antes
Que es expancion nesecitto eso
loretty, 12 Años Antes
¡Hola! Expansión es que un gas aumente su volumen, a eso lo llamamos expandirse.
QuimiTube, 12 Años Antes
¡Hola! Quería consultarte sobre el criterio de signos, tengo un libro que es el Brown, Lemay, etc; y toma al trabajo como W = F x d .
Luego toma a la variación de energía interna como ΔU = Q + W y además dice que el calor es positivo si gana calor y es negativo si pierde calor, el trabajo es positvo si se realiza trabajo SOBRE el sistema y es negativo si el trabajo es realizado POR el sistema pero concluye que el trabajo W = – P x ΔV .
Es entonces que mi duda es que tomo un criterio de signos contrarios a los que usted considero pero concluye en la misma ecuación que es la última mencionada y tengo entendido que esta ecuación también depende de qué criterios tomes como referencia.
Desde ya, Gracias.
Mar, 12 Años Antes
¡Hola! Este criterio de signos que comentas es el mismo que hemos empleado, a pie de vídeo indicamos:
«Si aumenta el volumen, es el gas, es decir, el sistema, el que realiza un trabajo mecánico. Según el criterio de signo que adoptaremos, que es el establecido por la IUPAC, este trabajo realizado por el sistema se considera de signo negativo, es decir, W < 0.", es decir, que hemos considerado negativo el trabajo realizado por el sistema, como el que tú indicas para el Brown. Por tanto, la fórmula W = -PxΔV será correcta. Espero haberte aclarado. Un saludo.
QuimiTube, 12 Años Antes
que bonito tu pelo :3
Martin, 11 Años Antes
🙂
QuimiTube, 11 Años Antes
NO entiendo…los signos del trabajo…
Creo que hay un error.
W 0 es que el gas hace el trabajo, pues el gas nos «da» su trabajo.
¿Estoy en lo cierto?
Revisa este detalle y confirma…
Gracias
José David Tejada, 11 Años Antes
¡Hola! En el vídeo digo que hay dos criterios, uno que se suele usar en ingeniería y otro el de la IUPAC, que es el que indico en el vídeo. Por eso esta «incongruencia», tal vez tú en clase hayas usado el otro criterio. Sin embargo, el criterio que usamos en el vídeo es también correcto.
QuimiTube, 11 Años Antes
Excelente video, Felicidades!
Mi duda es respecto a la convención de los signos.
Cómo queda la convención de signos para el calor de acuerdo a la IUPAC, y cual sería el inconveniente de NO seguir la convención de signos establecidos por la IUPAC para el calor y el trabajo.
Saludos
Jeremías, 11 Años Antes
Hola Jeremías, el criterio de la IUPAC, tal como indicamos en la explicación escrita a pie de vídeo, es que el trabajo realizado por el sistema es negativo y el trabajo realizado por el entorno positivo (el criterio de signos egoísta, decía mi profesora, considerando que nosotros somos el sistema y no nos gusta hacer trabajo). Si utilizas el otro criterio no pasa nada, siempre y cuando lo mantengas de forma consecuente en todos los cálculos que realices. Simplemente fíjate muy bien en que, una vez que has elegido un criterio, todo lo que hagas sigue ese criterio y que no mezclas ambos. Un saludo.
QuimiTube, 11 Años Antes
que libro me recomiendas de quimica?.muy buenos videos me han servido demasiado…muchas gracias
jordan hernandez, 10 Años Antes
¡Hola! Si es para un nivel preuniversitario te recomiendo el Santillana porque además tiene muchos ejercicios resueltos:
http://www.quimitube.com/libro-de-texto/quimica-2-bachillerato-santillana-2009-isbn-978-84-294-0993-2
Un saludo y mil gracias por tu comentario.
QuimiTube, 10 Años Antes
estos vídeos son los mejores, me sirven demasiado este tema en la u no me quedo muy claro y aquí mis dudas son aclaradas mucas gracias
Daniela, 10 Años Antes
Hola Daniela, mil gracias, me alegra que te sirvan. Un saludo grande.
QuimiTube, 10 Años Antes
muy buena expliacion , un abrazo
raul, 10 Años Antes
¡Gracias! Un saludo.
QuimiTube, 10 Años Antes
¿Qué pasa si el embolo tiene una masa de 8kg ?
sergio, 10 Años Antes
Muy buena explicación siguan adelante QUIMITUBE tienen muy buenos videos 🙂
Nicolas, 10 Años Antes
¡Muchas gracias y bienvenido!
QuimiTube, 10 Años Antes
Hola!, sólo una pequeña preguntita, qué unidades maneja este tipo de trabajo? Muy buena la explicación, ojalá y sigan creciendo, GRACIAS POR TODO!
Ali Terán, 10 Años Antes
¡Hola! Como todo trabajo tiene unidades de energía, en el sistema internacional julios.
QuimiTube, 10 Años Antes
el trabajo sobre el sistema es negativo
oscar avila, 9 Años Antes
Depende del criterio, como decimos en el vídeo aquí aplicamos el criterio de la IUPAC en el que el trabajo sobre el sistema es positivo.
QuimiTube, 9 Años Antes