Salvando a los crash test dummies: la química del airbag
Escrito por Quimitube el 26 noviembre
En este empeño tan férreo que tenemos los químicos últimamente de mostrar las bondades de la química (por cierta testarudez innata y por la insana costumbre que tiene la publicidad de presentar la química como el coco malo de la contaminación y un largo etcétera), en esta entrada voy a hablar de otra reacción química (¡otra más!) que se esconde tras el funcionamiento de un dispositivo cotidiano; éste, además, salva vidas: el airbag. De hecho, se estima que el accionamiento del airbag en caso de colisión frontal reduce el riesgo de muerte en torno a un 30%, siempre combinado con el cinturón de seguridad.
En la década de los 70 la casa Mercedes-Benz patentó el airbag para automóviles, aunque no fue hasta la de los 80 cuando se popularizó para un mayor número de vehículos hasta llegar a la actualidad, en la que la mayoría (si no todos) lo traen de serie. No obstante, estas bolsas hinchables para la protección frente a colisiones no surgieron de la industria automovilística: la primera patente se registró durante la Segunda Guerra Mundial para su uso en aviación.

Siniestra familia de crash test dummies esperando su turno
Cuando un objeto se halla en movimiento a una velocidad determinada, continuará dicho movimiento, a la misma velocidad y en la misma dirección, siempre y cuando no actúe sobre él una fuerza externa. En un vehículo, tanto éste como sus ocupantes se van moviendo a una velocidad determinada. Cuando el coche colisiona repentinamente, los pasajeros continuarán moviéndose a la misma velocidad a la que iba el coche hasta que una fuerza los detenga: es decir, el impacto contra el salpicadero o la luna delantera. Así, el objetivo de un sistema de retención como el airbag es lograr que los pasajeros se detengan al mismo tiempo que sufran el menor daño posible; el airbag debe actuar en una fracción de segundo.
¿Cómo se puede lograr que el airbag se active justo cuando se produce la colisión y antes de que los ocupantes se golpeen con las partes del vehículo? ¿Con qué se hincha un airbag? Se hincha, obviamente, con un gas. ¿Y de dónde procede ese gas? De una reacción química de cinética extremadamente rápida.
En un airbag, el gas se produce de forma explosiva y alcanza suficiente presión como para inflarlo en un intervalo de tiempo de entre 20 y 60 milésimas de segundo. La rapidez del proceso es tal que el volumen de gas producido hace que el airbag salga de su carcasa a una velocidad que supera los 300 km/h (¡más rápido que un parpadeo!).
La naturaleza, procedencia y almacenamiento de este gas fue el primer problema al que se enfrentaron los diseñadores de una bolsa anticolisiones. Los investigadores se hallaban con obstáculos como tener suficiente espacio en el coche para incorporar una bombona de gas que llenara el airbag; que el gas fuese estable y pudiese mantenerse a la presión adecuada durante toda la vida del vehículo; cómo lograr que el gas se expandiese de forma fiable y prácticamente inmediata, dentro de un rango relativamente amplio de temperaturas de operación y sin emitir gas ni explotar… Estos primeros intentos infructuosos por inflar la bolsa con un gas ya producido y almacenado, salvaron el escollo con el uso de una reacción química, que es como llevar el gas en una pastillita, ocupando poco volumen, y a punto de producirse en cuanto lo necesitemos (o sea, fenomenal, ¿no?).
Así pues… ¿qué características debe reunir el gas generado para inflar un airbag? Como podéis suponer, la mayoría de necesidades están enfocadas a la seguridad y a la velocidad de reacción, de forma que, esencialmente, son las siguientes:
- El gas usado no debe ser tóxico, por si se produce un escape del mismo o una rotura una vez hinchado el airbag.
- El gas debe ser “frío”, es decir, no debe producirse a elevadas temperaturas, para evitar que pueda producir quemaduras.
- El gas debe producirse muy rápidamente, ya que debe amortiguar el golpe tras el impacto, antes de que se produzca la colisión del ocupante con el vehículo. Por tanto, debe tratarse de una reacción química muy rápida: el tiempo que tarda en inflarse un airbag, como hemos dicho, está entre 20 y 60 ms.
- Finalmente, los productos químicos que generarán el gas, es decir, los reactivos, deben ser de fácil manejo y estables durante largos períodos de tiempo.
El compuesto capaz de generar un gas que cumple estas características es una acida, un compuesto que contiene el anión acida N3(-). En concreto, se trata de la acida sódica, cuya descomposición produce sodio y nitrógeno, que es un gas no tóxico (de hecho lo respiramos continuamente: el 79% de la atmósfera terrestre es nitrógeno, N2) según la reacción:
2NaN3 (s) –> 2Na(l) + 3N2(g)
Que la acida sódica cumpla las condiciones establecidas previamente, no implica que sea inocua. En realidad se trata de un compuesto tóxico (la dosis letal LD50 en ratas es de 27 mg/kg) y se absorbe a través de la piel. Entre de otras lindezas, el anión acida, N3(-), es capaz de inhibir una enzima, la citocromo c oxidasa, por formación de un enlace irreversible con el grupo hemo, de forma semejante a la unión del monóxido de carbono con este mismo grupo, tal y como vimos en la entrada relativa a la muerte dulce (asfixia por monóxido de carbono); además tiene efectos mutagénicos.
![]()
Además, como hemos visto, la reacción de la acida sódica pura produce nitrógeno caliente y un metal alcalino, el sodio. La mayoría de metales alcalinos reacciona violentamente con el agua (en este caso, el sodio reacciona con el agua produciendo hidróxido sódico y liberando hidrógeno gaseoso); por este motivo, en la actualidad la acida sódica se estabiliza en pastillas que contienen, además del NaN3, otros compuestos como óxido férrico, disulfuro de molibdeno y azufre.
Con esta mezcla se logra que la pastilla se siga descomponiendo rápidamente (los componentes adicionales tienen un efecto catalítico), pero se produce un gas frío con el que se evitan quemaduras. El sodio liberado reacciona y produce sulfatos que forman un residuo sólido inerte que se recoge fácilmente.
El sistema del airbag se activa mediante sensores que detectan el choque inicial e inician eléctricamente la explosión de una carga diminuta. Esta explosión, a su vez, origina la rápida descomposición de la pastilla que contiene acida de sodio, y se libera un gran volumen de N2 (g) que llena la bolsa. La bolsa permanece hinchada tan sólo unas décimas de segundo; pasado este tiempo, el gas producido comienza a disiparse por pequeños orificios presentes en la bolsa de nailon para permitir la movilidad de los ocupantes.
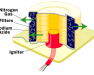
Por último, una vez que hemos visto la reacción química que hay detrás del airbag, vamos a ver cómo se aplica dicha reacción química al dispositivo en sí. ¿De qué elementos consta un airbag para poder funcionar? Pues esencialmente de tres: la bolsa de nailon, un detector de impacto y un sistema de inflado; se puede ver el sistema del airbag de un volante en la figura siguiente:
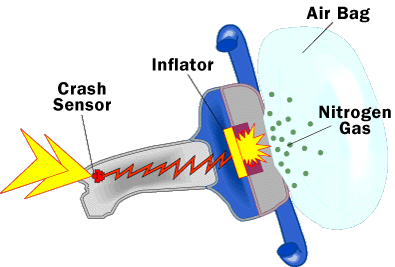
En la siguiente imagen se ve con mayor detalle el sistema de inflado:
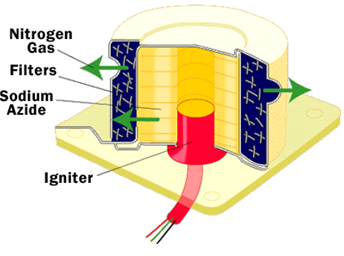
No obstante y a pesar de lo apañao’ que resulta tener un cojín amortiguador incorporado en el automóvil, recordad que el airbag siempre debe ser usado en combinación con el cinturón de seguridad. Los airbags trabajan sólo en colisiones frontales que ocurren a más de 6 kilómetros por hora. Sólo los cinturones de seguridad pueden ayudar en otros tipos de colisiones. Además, la fuerza con la que se infla el airbag también puede dañar seriamente a un pasajero si se halla muy cerca de él. Se ha determinado que la zona de riesgo se halla en torno a 5-8 cm de la zona de llenado y que la zona de seguridad está a partir de 25 cm del volante como margen de seguridad.
Para ilustrar un poco mejor lo aquí expuesto, os dejo este interesante vídeo de un crash test de Toyota donde se puede apreciar la colisión en cámara extremadamente lenta, así como la indicación de los fotogramas y el tiempo transcurrido.
¡Qué haría nuestra simpática y siniestra familia de dummies sin la acida sódica!





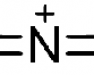
Información Bitacoras.com…
Valora en Bitacoras.com: En este empeño tan férreo que tenemos los químicos últimamente de mostrar las bondades de la química (por cierta testarudez innata y por la insana costumbre que tiene la publicidad de presentar la química como el coco malo de…..
Bitacoras.com, 13 Años Antes
[…] "CRITEO-300×250", 300, 250); 1 meneos Salvando a los crash test dummies: la química del airbag http://www.quimitube.com/salvando-a-los-crash-test-dummies-la-qu… por equisdx hace […]
Salvando a los crash test dummies: la química del airbag, 13 Años Antes
[…] Salvando a los crash test dummies: la química del airbag […]
¿Por qué no se debe mezclar la lejía con el salfumán? | Quimitube, 12 Años Antes