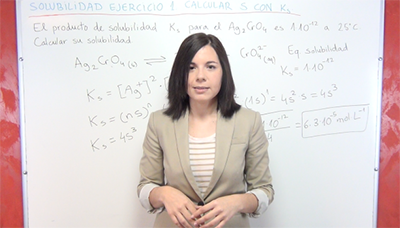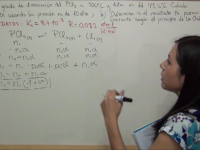-

Solubilidad ejercicio 3: Determinar si se forma precipitado de PbI2
En este ejercicio debemos determinar el valor de Ks para PbI2 y también saber si se formará un precipitado al mezclar dos disoluciones. Ver video -

Equilibrio Químico Ejercicio 16: Cálculo de Kp y de las presiones parciales para la reacción de formación de HF
En este ejercicio resuelto 16 de equilibrio químico calcularemos Kp a partir de Kc, así como las presiones parciales y la cantidad que queda sin reaccionar de H2. Ver video -

Equilibrio Químico Ejercicio 15: Calcular Kp y Kc con los moles iniciales para H2Se
Calcular las constantes Kc y Kp a partir de los moles iniciales en el equilibrio de formación de H2Se con Se y H2. Ver video -

Equilibrio Químico Ejercicio 14: Calcular las nuevas concentraciones cuando se altera el equilibrio
Cuando un sistema está en equilibrio y se añade cierta cantidad de reactivo, el equilibrio se altera y las concentraciones se modifican. Ver video -

Equilibrio Químico Ejercicio 13: Calcular Kc a partir de Kp en un equilibrio heterogéneo
En este ejercicio calcularemos el valor de Kc a partir de Kp y de Pt para un equilibrio heterogéneo en el que un sólido (HgO) se descompone para dar gases. Ver video -

Equilibrio Químico Ejercicio 12: Calcular la concentración y alfa a partir de Kc para el COBr2
Calcularemos la concentración de las especies en el equilibrio y el grado de disociación a partir del valor de Kc de la reacción y número de moles iniciales. Ver video -

Equilibrio Químico Ejercicio 11: Calcular alfa y Kp con la presión total y los moles iniciales
En este ejercicio resuelto de equilibrio químico vamos a calcular el grado de disociación de Kp a partir de la presión total en equilibrio y moles iniciales. Ver video -

Equilibrio Químico Ejercicio 10: Calcular alfa a partir de Kp
En este ejercicio resuelto 10 de equilibrio químico vamos a calcular el valor de alfa (grado de disociación) a partir la presión total y el valor de Kp. Ver video -

Equilibrio Químico Ejercicio 9: Calcular Kc con la concentración inicial y el grado de disociación
Ejercicio de calcular la constante de equilibrio Kc a partir de la concentración inicial y el grado de disociación, alfa. Ver video