Contenido del Vídeo
Experimentalmente se observa que la velocidad de una reacción química aumenta al aumentar la temperatura. Esta es, por ejemplo, la base de guardar los alimentos en el frigorífico: al bajar la temperatura, las reacciones e deterioro de los mismos se ralentizan y el alimento permanece durante más tiempo apto para su consumo. Ya en el año 1889, Svante Arrhenius determinó, a partir de datos experimentales, la siguiente relación entre la constante de velocidad de una reacción y la temperatura a la cual transcurre la misma, ecuación que recibe el nombre de ecuación de Arrhenius:
k = A·e-Ea/RT
Donde:
k: constante de velocidad de la reacción. Las unidades dependerán del orden global.
A: factor de frecuencia o factor preexponencial. Es un índice relacionado con la frecuencia de las colisiones entre las moléculas de reactivos y sus unidades dependerán de las de k.
Ea: energía de activación de la reacción, normalmente dada en kJ·mol-1
R: constante de los gases ideales. Si Ea viene dada en kJ·mol-1, su valor es 8,31·10-3 kJ·mol-1·K
T: temperatura, en kelvin
Esta expresión nos indica que la constante de velocidad, k, y por tanto la velocidad, v, es directamente proporcional a la frecuencia de las colisiones. También aumentará al aumentar la temperatura y al disminuir la energía de activación. Es decir, cuanto mayor sea la temperatura, más rápido transcurrirá la reacción, y cuanto menor sea la energía de activación, también será más rápida.
La ecuación de Arrhenius se suele utilizar en los cálculos linealizada, lo cual se logra aplicando logaritmos neperianos a cada lado de la ecuación del siguiente modo:
ln k = ln (A·e-Ea/RT)
ln k = ln A + ln(e-Ea/RT)
Ecuación de Arrhenius linealizada:
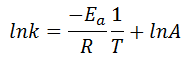
Esta forma de expresar la ecuación de Arrhenius es muy útil para determinar la energía de activación de una reacción, ya que si se determina experimentalmente el valor de la constante de velocidad a distintas temperaturas, la representación de lnk (y) frente a 1/T (x), nos da una línea recta cuya pendiente es -Ea/R y su ordenada en el origen es lnA, comparando la expresión anterior con la ecuación explícita de una recta:
y = mx + n
A continuación tienes algunos vídeos de ejercicios resueltos en los que aplicamos dicha ecuación de Arrhenius linealizada para realizar distintos cálculos, como calcular la constante de velocidad a una temperatura determinada o la energía de activación.
También te puede interesar:
Cinética Química Teoría 5: Velocidad de reacción y concentración
Cinética Química Teoría 7: Factores que afectan a la velocidad de una reacción química
Cinética Química Teoría 9: Mecanismo de acción de un catalizador
Category: Cinética Química y Teoría de Cinética Química.
Etiquetas: Ecuación de Arrhenius, Energía de activación y Velocidad de reacción.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad