Contenido del Vídeo
¿Qué entendemos por reacción reversible?
Existen reacciones químicas que, una vez iniciadas, transcurren hasta que los reactivos (o el reactivo que se halle en defecto) se consumen por completo. Estas reacciones tienen lugar en un solo sentido (hacia la derecha) y se denominan reacciones irreversibles, representándose con una sola flecha:
2H2(g) + O2(g) → 2 H2O(g)
Sin embargo, otras reacciones pueden tener lugar en los dos sentidos, pues los productos pueden volver a reaccionar entre sí para dar nuevamente los reactivos. Es decir, estas reacciones pueden transcurrir hacia la derecha y hacia la izquierda. Estos procesos se denominan reacciones reversibles, y se simbolizan mediante una doble flecha:
I2(g) + H2(g) ⇔ 2HI(g)
¿Qué es el equilibrio químico?
Consideremos que la siguiente reacción reversible se produce a una determinada temperatura en un recipiente cerrado:
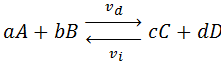
Donde:
vd: velocidad de formación de los productos (reacción hacia la derecha)
vi: velocidad de descomposición de los productos para dar nuevamente reactivos (reacción hacia la izquierda)
Al principio de la reacción, en el recipiente solo habrá reactivos, A y B. De esta forma, la velocidad de formación de productos C y D al principio será máxima, pues también son máximas las concentraciones de A y B. A medida que A y B se consumen, la velocidad de la reacción directa disminuye, ya que cada vez es menor la concentración (recordemos que vd = kd·[A]n·[B]m).
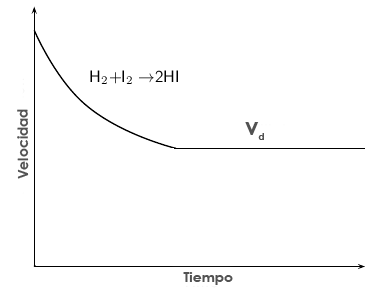
Velocidad de la reacción directa frente al tiempo, vd. Al principio es máxima y va disminuyendo con el tiempo.
Por otra parte, los productos C y D se van formando y cada vez es mayor su concentración en el recipiente. Esto hace que puedan encontrarse y volver a reaccionar entre sí para regenerar A y B. Al principio, como la concentración de C y D es nula, la velocidad de esta reacción inversa será también nula. Pero a medida que dichas concentraciones van aumentando la reacción inversa aumenta su velocidad y no es desdeñable:
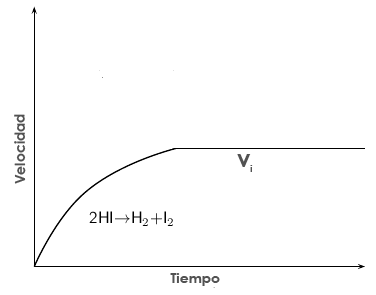
Velocidad de la reacción inversa con el tiempo, vi. Al principio es nula y va aumentando a medida que aumentan las concentraciones de productos.
Ambas velocidades, la de la reacción directa y la de la reacción inversa, finalmente se igualan, y los productos C y D se forman a la misma velocidad que se consumen, por lo que ya no experimentan variación en su concentración. Esta situación se denomina equilibrio químico, y en ella, las concentraciones de reactivos y productos permanecen constantes en el tiempo si las condiciones externas del sistema (presión, temperatura…) no se modifican. A pesar de que las concentraciones permanezcan invariables en el tiempo, el equilibrio químico es una situación dinámica en la cual la velocidad de la reacción directa (hacia la derecha) e inversa (hacia la izquierda) son iguales. Por tanto, no veremos variación en las concentraciones de las especies reaccionantes porque se produce de cada una de ellas tanto como se consume, pero sigue habiendo reacción en ambos sentidos. El equilibrio químico se mantendrá indefinidamente si el sistema permanece cerrado y a la misma temperatura.
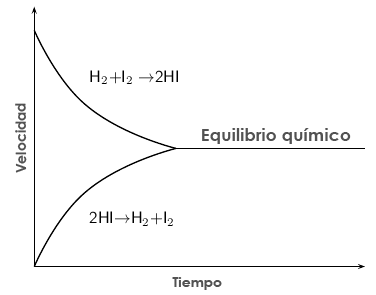
Cuando se alcanza el equilibrio químico, las velocidades de la reacción inversa y de la reacción directa son iguales, por lo que las concentraciones permanecen invariables en el tiempo.
Cuando la reacción alcanza el equilibrio, la variación de energía libre, ΔG, es 0.
¿Cómo se clasifican los equilibrios químicos?
Los equilibrios químicos se pueden clasificar en función del estado de agregación en el que se encuentran reactivos y productos. Así, distinguimos entre equilibrios homogéneos y heterogéneos.
- Un equilibrio homogéneo es aquel en el que los reactivos y los productos se encuentran en el mismo estado de agregación, como las reacciones en fase gas o en disolución:
N2O4(g) ⇔ 2NO2(g)
CH3COOH(aq) ⇔ H+(aq) + CH3COO–(aq)
- Un equilibrio heterogéneo es aquel en el que los reactivos y los productos se encuentran en distinto estado de agregación. Por ejemplo, cuando un sólido se descompone térmicamente y desprende un gas:
CaCO3(g) ⇔CaO(s) + CO2(g)↑
O el equilibrio entre una disolución saturada y su precipitado:
AgCl(s) ⇔Ag+(aq) + Cl–(aq)
En la mayor parte del tema nos centraremos en los equilibrios homogéneos, mientras que hablaremos de equilibrios heterogéneos cuando tratemos la solubilidad de sales y la precipitación.
También te puede interesar:
Equilibrio Químico Teoría 2: Constante de equilibrio. Ley de acción de masas.
Category: Equilibrio Químico, Teoría de Equilibrio Químico y Vídeos Equilibrio Químico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Estimada profesora, le comento que al ver los temas completos de termodinámica y cinética por sus vídeos he visto la luz. Increíblemente algo que era incapaz de conectar de principio a fin con solo el libro, tomo cuerpo y aunque no sea una experta, puedo decir que ahora entiendo y ademas he pasado de tener una cierta alergia a algo indescifrable, a sentir gusto por estos temas.
Es su mérito, ya que la claridad de sus explicaciones son una maravilla y por ello le estoy muy agradecida.
Al querer continuar con la teoría de equilibrio químico, mi ánimo se vino al suelo cuando en la barra de link izquierda de la página solo estaba el de ejercicios. No me lo podía creer…
Empecinada por conseguir sus teorías, rebusque por la página y halle la teoría. Estoy la mar de contenta.
Aunque es un detalle, le recomiendo que revise el link en esa barra izquierda para que sus alumnos que venimos disfrutando con las clases, no perdamos ni un segundo la sonrisa.
Un gran abrazo.
Carina, 10 Años Antes
Excelente! me sirvió mucho.
carolina, 10 Años Antes
yo soy totalmente inexperta pero quisiera salir de la duda, quiero saber si la k sub c tiene alguna relación con el equilibrio quimico
nathaly Montaño, 5 Años Antes
¡Hola! Sí, la K sub c es la constante de equilibrio, y es esencial por tanto en este tema. Te sugiero continuar viendo los vídeos de equilibrio químico en orden a partir de éste. Un saludo.
QuimiTube, 5 Años Antes