Contenido del Vídeo
En este ejercicio determinaremos la energía reticular del fluoruro cálcico, CaF2, tanto a partir del ciclo de Born Haber como de la ecuación de Born Landé, comparando ambos valores.
El enunciado completo es:
A partir de los datos expuestos, calcular la energía reticular del fluoruro cálcico a partir del ciclo de Born-Haber y de la ecuación de Born-Landé.
ΔHsub (Ca) = 193 kJ/mol
(entalpía de sublimación del calcio, es decir, energía necesaria para pasar el calcio de sólido a vapor).
EI1 (Ca) = 540 kJ/mol
(primera energía de ionización del calcio, es decir, energía necesaria para abstraer un electrón de valencia del calcio gaseoso, quedando el catión Ca+ también en estado gaseoso).
EI2 (Ca) = 1150 kJ/mol
(segunda energía de ionización del calcio, es decir, energía necesaria para abstraer el segundo electrón de valencia del catión Ca+, quedando como catión Ca2+, en estado gaseoso).
ΔHdis (F2) = 158 kJ/mol
(entalpía de disociación del flúor, energía necesaria para disociar la molécula diatómica F2 a átomos individuales, F(g)).
AE (F) = -333 kJ/mol
(afinidad electrónica del flúor, energía desprendida cuando un átomo de flúor capta un electrón para quedar como anión fluoruro, F–).
ΔHf (CaF2) = -1214,6 kJ/mol
(entalpía de formación del fluoruro de calcio, energía desprendida cuando se forma un mol del compuesto sólido a partir de sus elementos en estado natural, es decir, calcio metálico sólido y flúor diatómico y gaseoso).
Distancia interiónica = 2,35 Å
Cte de Madelung = 2,5194
Coef. Born o factor de compresibilidad = 8
K (constante de Coulomb) = 9·10^9 N·m2/C2
e = 1,60·10-19 C
El ciclo de Born-Haber para este compuesto se representa del siguiente modo:
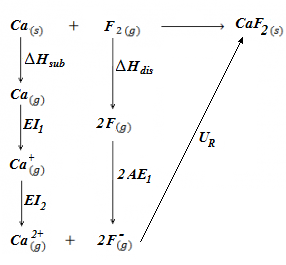
Tal vez también te interese:
Ciclo de Born-Haber para el fluoruro sódico, NaF
Ordenar de mayor a menor energía reticular KI, CaS, KF y CaO
Energía reticular y punto de fusión de NaF, KF, LiF y NaF, NaCl, NaBr
Comparación de la dureza de dos compuestos iónicos por la ecuación Born-Landé
Cálculo de la energía reticular del bromuro potásico, KBr, por el Ciclo de Born-Haber
Cálculo de la energía reticular del óxido de magnesio, MgO, por el Ciclo de Born-Haber
Cálculo de la afinidad electrónica del cloro por el Ciclo de Born-Haber
Demostrar la no existencia del compuesto NaO con el Ciclo de Born-Haber
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Ciclo de Born-Haber, Ecuación de Born-Landé y Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
hola, gracias por tus clases tan didácticas. En el ejercicio 28 lo comprendo todo perfectamente, pero en los cálculos obtengo un resultado con valor negativo y tu lo pones positivo.
No se si he calculado mal por no tener un concepto de matemáticas elementales claro o es que debe ser negativo.
gracias
JUANVI, 12 Años Antes
¡Hola! Gracias por tu comentario 🙂
No te preocupes por lo del signo, he sido yo me lo he olvidado por el camino. Es mejor que la energía reticular la pongas siempre negativa, porque según la hemos definido nosotros en este curso es energía desprendida (algunos libros la definen como energía aportada y entonces la ponen positiva, pero es más habitual negativa).
QuimiTube, 12 Años Antes
Gracias por estas clases! En verdad me ayudan mucho gracias gracias gracias
hito, 11 Años Antes
¡Gracias a ti por tu comentario!
QuimiTube, 11 Años Antes
¿Que pasa si la energía calculada por la ecuación de Born Lande es menor que la energía calculada por el ciclo de Born Haber?
Carla, 11 Años Antes
¡Hola! Lo normal es que haya ciertas diferencias pero no demasiadas (varias unidades a lo sumo). ¿La diferencia que calculaste es muy grande? Si hay demasiada diferencia buscaría un error en los cálculos. Un saludo.
QuimiTube, 11 Años Antes
¡Hola!
Me gusta mucho tus vídeos pues nos viene muy bien como complemento a las clases para nuestro alumnado. Solo una cosita. La nomenclatura empleada ya no está permitida (me refiero a la adjetivación del metal, «cálcico», sino que deberíamos cambiarlo por de calcio.
Por otra parte, al final un despiste, aparece el valor de la carga del electrón sin elevar al cuadrado, aunque la unidad si que refleja ese cuadrado.
Muchas gracias
Juan Carlos Romero Florido, 11 Años Antes
Hola Juan Carlos, mil gracias por tu aporte. Tienes toda la razón en cuanto a la formulación, yo soy la primera que indico esto a los alumnos y luego no me puedo quitar de la mente el «cálcico», «sódico» o «potásico». Es muy duro cuando has trabajado mucho tiempo en un laboratorio cambiar estas palabras tan manidas. En cuanto a la carga del electrón gracias también por el comentario, a veces ante la cámara se me pasan cosas que después veo más evidentes. Un saludo grande.
QuimiTube, 11 Años Antes
Hola! No sé cómo salen las unidades en J/mol. Y tampoco sé a lo que equivale N de la constante de Coulomb.
Vanessa Maroto Juan, 9 Años Antes
Muchas gracias este video fue muy útil para repasar para un parcial gracias por esa ayuda.Bendiciones
Juan Camilo, 8 Años Antes