-

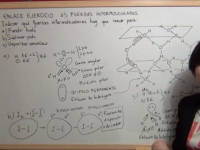
Ejercicio Enlace Químico 1: Determinación del tipo de enlace entre dos elementos a partir de sus configuraciones electrónicas
En este ejercicio 1 de Enlace Químico determinaremos el tipo de enlace que se dará entre dos elementos a partir de las configuraciones electrónicas de los mismos. Ver video -
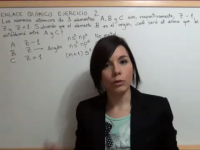
Enlace Químico Ejercicio 2: Determinación del tipo de enlace de dos elementos con configuraciónes Z+1 y Z-1, siendo Z argón
En este ejercicio 2 de Enlace Químico determinaremos el tipo de enlace entre dos elementos A y C sabiendo que sus números atómicos son Z+1 y Z-1. Ver video -

Ejercicio Enlace Químico 3: Determinación del tipo de enlace a partir de los números cuánticos n y l del último electrón
En este ejercicio 3 de Enlace Químico vamos a determinar el tipo de enlace que se podrá establecer entre varios elementos sabiendo los números cuánticos n y l del último electrón. Ver video -

Ejercicio Enlace Químico 4: Estructuras de Lewis de algunas moléculas covalentes sencillas (sin resonancia)
En este ejercicio determinaremos la estructura de Lewis de algunas moléculas sencillas sin resonancia: H2O, NH3, CO, H2S, N2, BF3, HCN, ICl3, PCl3, SF6 y BeCl2 Ver video -

Ejercicio Enlace Químico 5: Estructuras de Lewis de algunas moléculas con resonancia: O3, CO2, N2O, NO y NO2
En este ejercicio resuelto de enlace químico determinaremos las estructuras de Lewis de algunas moléculas que presentan resonancia, como el ozono, el dióxido de carbono y algunos óxidos de nitrógeno. Ver video -

Enlace Químico Ejercicio 6: Estructuras de Lewis de los oxoácidos del cloro
En este ejercicio determinaremos las estructuras de Lewis de los oxoácidos del cloro, es decir, ácido hipocloroso, cloroso, clórico y perclórico. Ver video -

Enlace Químico Ejercicio 7: Estructuras de Lewis de aniones hipocloroso, nitrito, nitrato, sulfito, carbonato y sulfato
En este ejercicio determinaremos las estructuras de Lewis de algunos aniones: hipocloroso, silicato, nitrito, nitrato, carbonato, sulfito y sulfato. Ver video -

Enlace Químico Ejercicio 8: Estructuras de Lewis especies orgánicas (metanol, etanol, benceno, acetato, acetona)
En este ejercicio de enlace químico determinaremos las estructuras de Lewis de algunas especies orgánicas (metanol, etanol, benceno, acetato, acetona). Ver video -

Enlace Químico Ejercicio 9: Cálculo del porcentaje de carácter iónico con el momento dipolar y la distancia de enlace
En este ejercicio calcularemos el % de carácter iónico de varios enlaces a partir de sus momentos dipolares y sus distancias de enlace. Ver video