Contenido del Vídeo
Una reacción química consiste en el reagrupamiento o reordenamiento de los átomos de los reactivos para formar los productos. Así, algunos enlaces de los reactivos se rompen y se forman enlaces nuevos para dar las moléculas de los productos. Conociendo qué enlaces se rompen y qué enlaces se forman durante una reacción, es posible calcular su entalpía de reacción a partir de las energías de dichos enlaces. Ahora bien, los valores de entalpía de enlace son valores medios e imprecisos, y por este motivo sólo se usan para calcular entalpías de reacción de forma aproximada, cuando no se dispone de valores experimentales de entalpías de formación. En todo caso, son más fiables las entalpías de reacción calculadas a partir de las entalpías de formación que de las entalpías de enlace.
La fórmula empleada para calcular la enltapía de reacción con las energías de enlaces rotos y enlaces formados es:
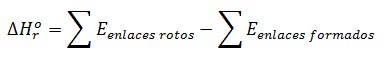
Para considerar la energía de los enlaces rotos, hay que tener en cuenta la entalpía de cada tipo de enlace y multiplicar la misma por el número de enlaces que se rompen dentro de una molécula y por el coeficiente estequiométrico de la molécula de la cual proceden.
Veamos un ejemplo muy sencillo de cálculo de la entalpía de reacción para el cloruro de hidrógeno, HCl:
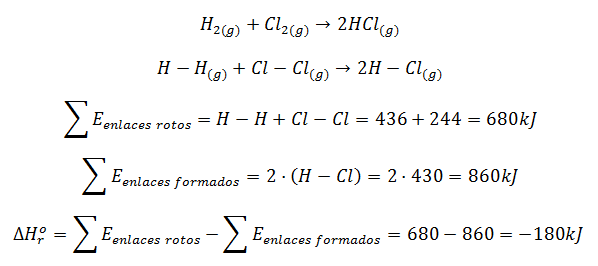
Como este valor obtenido es para la formación de 2 moles de HCl, para 1 mol de HCl la entalpía será la mitad, -90 kJ/mol.
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Holaaa!!! Una pregunta, en el vídeo salen entalpía de formación !!! el titulo pone de enlace y en el vídeo de Ley de Hess pone que aquí son de enlace… esta bien todo ? no me extrañaría que yo me equivocase… jaja un saludo muy grande
Pedromagna, 12 Años Antes
Jajaja, menosmal que tú te has dado cuenta, este es el ejercicio 13, no la teoría 13, me he equivocado. Ahora mismo lo cambio, ¡gracias!
Quimitube, 12 Años Antes
No hay de que, me alegro, un saludo grande ^ ^
Pedromagna, 12 Años Antes
Hola buenas, tengo un problema, m piden calcular la entalpia de formación del agua (gas), a partir de las energias de enlace H-H; O=O y H-O. Dichas energias son 436KJ/mol, 494KJ/mol y 460J/mol
La reaccion evidentemente es H2+O2 para dar 2H2O
o H2+ 1/2O2 para dar H20
El caso es q haciendo con la primera ecuacion como tu explicas m da una solución de 10KJ/2 moles y su solucion no esa. Si lo hago con la otra me da 223KJ/mol y tampoco es correcto ya que la entalpia de formacion del agua gas es negativo.
M pregunta es que es lo q toy haciendo mal?
y segundo si con tu ejemplo haces la de H2+1/2Cl2 para dar HCl, el resultado es 128KJ/mol
manuel, 12 Años Antes
Tengo una duda referente a lo explicado en el video anterior donde usted pantea que la entalpia de formacion de los elementos puros o sea O2, H2 etc es cero y en este me habla que tienen un valor de entalpia de enlace. ¿Como se explica eso?
Soy un seguidor fiel de sus video y aunque esta es la primera vez que haga una pregunta, los he visto casi todos
Pablo, 12 Años Antes
¡Hola Pablo!
Todos los enlaces tienen una energía y por tanto un valor de entalpía. Así, en enlace O=O tendrá su valor, H-H el suyo… Todos, siempre. Otra cosa es la entalpía de formación del elemento que es cero porque es una variación y no un valor absoluto. Por definición, la entalpía de formación de un compuesto es la entalpía de la reacción de ese compuesto a partir de sus elementos en estado natural. El elemento oxígeno en estado natural es el propio O2, por lo que esta definición nos lleva a que la reacción de formación de O2 sería:
O2 (g) –> O2 (g), como ves, de sí mismo a sí mismo (físicamente no tendrá sentido), y por tanto la variación de entalpía de formación será: entalpía de productos – entalpía de reactivos = 0. Si lo calculases con energías de enlace también te daría 0, porque tendrías que la entalpía de formación sería: energía de los enlaces rotos – energía de los enlaces formados, es decir, energía del enlace O=O – energía del enlace O=O, como resultado, cero. Sin embargo, como verás en la expresión, que la resta de ambos valores iguales dé 0 no significa que la energía del enlace O=O sea cero, una energía de enlace absoluta no puede ser nula.
Espero que la explicación se entienda.
Un saludo.
QuimiTube, 12 Años Antes
asta pagina para mi ha sido de mucha pero de mucha ayuda por que soy una persona de edad mayor (57 años) y estudio en un intituto y ahi los profesores no se dan el tiempo para repasar las materias de ahí mi interes por esta pagina
marta jaque, 12 Años Antes
Hola Marta, bienvenida, eres el primer comentario de 2014 🙂 Me alegra que te haya servido la página. Un abrazo.
QuimiTube, 12 Años Antes
Hola, tenía una duda en lo referente a las unidades de entalpía,¿cuál es el criterio para poner Kj o kj/mol?Gracisas d
omar, 12 Años Antes
Hola Omar, lo más habitual es que la entalpía venga dada en kJ/mol, que es por cantidad de sustancia. Hay muy pocos casos en los que no lo pondrás por mol, y será si en el propio enunciado en lugar de darte kJ te dan los kJ desprendido globalmente en cierta reacción química (por ejemplo, kJ desprendidos en la combustión de 100 gramos de un compuesto). Un saludo.
QuimiTube, 12 Años Antes
Hola ,antes que todo agrecerle sus explicaciones. Mi duda es con relación a las unidades que hay que emplear para la entalpía,no se en qué hay que fijarse para saber si es en Kj o en Kj/mol,según unos apuntes de clase que tengo se trata de determinar si es extensiva(depende de la materia) o o intensiva(no depende de la materia). ¿Me podría poner un ejemplo de cuando es intensiva y cuando extansiva? Gracias d antemano
omar, 12 Años Antes
Hola nuevamente, Omar, te sugiero que veas este vídeo o leas el pie de vídeo:
http://www.quimitube.com/videos/termoquimica-teoria-2-variables-termodinamicas-y-funciones-de-estado/
Un saludo
QuimiTube, 12 Años Antes
Holaaaa! Tengo una duda sobre las unidades de la entalpia,he visto qe a veces se pone en kilojulios y otras en kilojulios por mol.¿cómo se cuando tengo que poner unas unidades y no otras?te agradeceria qe me respondieses pronto,tengo examen de termoquimica pasado mañana. Un saludo;)
Por cierto enhorabuena por los vídeos,ya le gustaría a más de uno explicarse así
javier, 12 Años Antes
¡Hola Javier! Lo siento mucho, no me fue posible responderte antes y veo que ya te examinaste. Espero que te fuese bien el examen de todos modos y te agradezco mucho tu comentario. Un saludo.
QuimiTube, 12 Años Antes
determinar la entalpia de reaccion a 727ºC de la siguiente reaccion:
N2 + H2 = NH3
ayuda porfa ……XDD
noeli, 11 Años Antes
¡Hola! Te sugiero que veas los vídeos que tenemos sobre entalpía de reacción y luego intentes hacer el ejercicio. La idea es que vosotros mismos aprendáis a hacer los ejercicios, no que se os resuelvan. Si sigues teniendo dudas tras ver los vídeos y realizar los ejercicios de los vídeos nos comentas. Un saludo.
QuimiTube, 11 Años Antes
Que rápido se aprende esta materia con estos videos….. a demás con una profesora tan bella es difícil no aprender, repasare los videos una y otra vez… Saludos y gracias.
Rodrigo, 11 Años Antes
Hola Rodrigo, muchas gracias por tu comentario, me alegra mucho que te sirva para aprender la materia que es muy interesante y no tan difícil como la pintan. Un saludo.
QuimiTube, 11 Años Antes
Hola buenas, si el enlace Cl-H se forma, ¿no debería ir en negativo? Es decir, sería 436 + 244 – 2 (-430) = 1540 kJ/mol
Kaesar, 10 Años Antes
¡Hola! Fíjate que en la fórmula ya tenemos en cuenta que se trata de un enlace formado, porque hacemos E = E enlaces rotos – E enlaces formados. Este signo – de la fórmula ya tiene en cuenta este hecho, por lo que no debes cambiarle el signo por segunda vez, ya que al final lo que harás es -·- = +.
QuimiTube, 10 Años Antes
Muchas gracias, ahora me queda claro 😉
Kaesar, 10 Años Antes
Hola, me quedó una duda. En el ejemplo que das, la entalpía es en condiciones estándar. ¿El HCl (ácido clorhídrico o cloruro de hidrógeno) no debería ser líquido en esas condiciones?
Muy buenos vídeos.
Javier, 9 Años Antes
¡Hola! Realmente «ácido clorhídrico» y «cloruro de hidrógeno» hacen referencia a dos cosas distintas. El ácido clorhídrico es una disolución de cloruro de hidrógeno en agua, pero nunca el compuestos solo, HCl. Si solo tenemos HCl (no disuelto en agua) entonces hay que denominarlo siempre como «cloruro de hidrógeno». El HCl como tal tiene un punto de ebullición de -85 ºC, por tanto, a temperatura ambiente es siempre un gas. Otra cosa es que tuvieses ácido clorhídrico, es decir, HCl en disolución, y por tanto estaría en estado (aq), disuelto. Un saludo.
QuimiTube, 9 Años Antes
Qué tal. Gracias por el aporte de antemano. Tengo una duda. Por qué no hay tablas de entalpía de enlaces iónicos? Saludos desde México.
Juan José, 9 Años Antes
Hola Juan José, el enlace iónico no es un enlace direccional como el covalente que se da entre dos átomos, es una atracción electrostática entre una gran cantidad de iones de distinto signo, por lo que no existe un único enlace iónico. En todo caso hay entalpía de formación de un mol de compuesto, pero no entalpía de enlace. Un saludo.
QuimiTube, 9 Años Antes
En el CO2 que enlaces se forman y cuáles se rompen?
J, 5 Años Antes
La molécula de CO2 tiene dos enlaces dobles C=O. Si se forma CO2 y por tanto es un producto contarás la energía liberada por este enlace multiplicada por dos y si se rompen, porque es un reactivo, pues lo mismo pero la energía necesaria para romperlo. Eso lo ves en las tablas de energías de enlace. Te sugiero ver todos los vídeos que tenemos de teoría y ejercicios sobre entalpías de enlace y leer la parte teórica a pie de vídeo.
QuimiTube, 5 Años Antes
Hola! me gustaria saber si hay alguna regla general para saber en que estado se encuentra un elemento en una reacción.
Muchas gracias
Carmen, 5 Años Antes
¡Hola! Es más bien una cuestión de experiencia y práctica, aunque hay algunos que son claros, como los gases diatómicos O2, H2, F2 o Cl2, por ejemplo. Por lo demás, regla general que puedas aplicar siempre yo no conozco ninguna…
QuimiTube, 5 Años Antes
Hola ,la verdad estoy estudiando optometria, ya soy adulto y no entiendo muy bien la química , será posible que usted me pueda ayudar a resolver este problema . Determinar correctamente la entalpia de reacción de HCI con NH3 y gráficas en un papel milimétrica.Gracias saludos
Rogelio, 5 Años Antes
Hola Rogelio, para el cálculo de la entalpía de reacción lo primero que debes hacer es ajustar la reacción entre el HCl y el NH3 y después tener las entalpías de formación de estos compuestos, como hacemos en otros vídeos (te sugiero ver la teoría de cálculos de entalpía en orden). Ahora bien lo de las gráficas en papel milimétrico no sé a qué se refiere…
QuimiTube, 5 Años Antes