Contenido del Vídeo
Hemos visto en los apartados previos, el 6 y el 7, la aplicación del Primer Principio de la Termodinámica a las reacciones que transcurren a volumen constante, en cuyo caso la transferencia de calor recibe el nombre de Qv, y a las reacciones que transcurren a presión constante, que da lugar a QP. Asimismo, hemos deducido que:
ΔU = QV y ΔH = QP
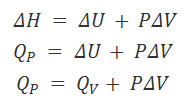
A partir de esto podemos deducir la relación entre la variación de entalpía y la variación de energía interna.
-
Relación entre QP y QV para sólidos y líquidos
En el caso de las reacciones en las que sólo intervienen sólidos o líquidos, podemos considerar que la variación de volumen entre reactivos y productos es muy pequeña y que el producto PΔV es despreciable. Así se obtiene
QP = QV, o también, ΔH = ΔU
-
Relación entre QP y QV para gases
En cambio, si en las reacciones intervienen especies gaseosas, que haya o no variación de volumen dependerá de la variación del número de moles de especies gaseosas enre reactivos y productos:
PV = nRT
PΔV = ΔnRT
Utilizamos la ecuación ya conocida QP = ΔU + PΔV y sustituiremos PΔV por ΔnRT y obtenedremos:
![]()
![]()
La variación de volumen dependerá de la variación del número de moles, ya que a más cantidad de moles gaseosos, manteniendo la presión constante, será mayor volumen.
Sólo si Δn = 0, entonces QP = QV, sino QP ≠ QV
Para calcular Δn en una reacción vamos a ver un ejemplo concreto, consideremos la reacción de combustión del metano:
La variación del número de moles corresponde a la suma de los coeficientes estequiométricos de los productos menos la suma de los coeficientes estequiométricos de los reactivos, es decir:
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Gracias! entendi todo! 🙂
Sachet, 12 Años Antes
Me surge la siguiente duda:
Si H=U+pV
Entonces ΔH=ΔU+pΔV+VΔp
¿Por qué se prescinde del sumando VΔp al deducir la relación entre Qp y Qv?
Muchas gracias y enhorabuena por unas explicaciones tan claras.
Saludos
Javier, 12 Años Antes
Hola Javier, muy buena apreciación. Debería haber mencionado que aplicamos la suposición de que estamos a presión constante, ya que la entalpía, H, es siempre a presión constante, que son los sistemas más habituales. Si aplicamos esto, el sumando que tú has considerado VDP se convierte en 0 y lo obviamos. Un saludo grande.
QuimiTube, 12 Años Antes
Muchas gracias.
Sois los mejores
Javier, 12 Años Antes
¡De nada! Gracias por tu apoyo y tus comentarios. Un abrazo.
QuimiTube, 12 Años Antes
hola, muchas gracias por tus aportes de verdad 😀 .. ¿estudiaste ciencias químicas? te super agradezco porque me ha servido de mucha ayuda . gracias (Y)
Alonso, 12 Años Antes
¡Hola Alonso! Muchas gracias 🙂 Sí, estudié químicas, es mi área. Un saludo.
QuimiTube, 11 Años Antes
Quiero saber si tienes el solucionario de fisicoquimica de maron y prutton, es que quiero checar las respuestas del problema numero 3 del capitulo 4
juan lopez, 11 Años Antes
¡Hola Juan! No , no lo tenemos, lo lamento. Un saludo.
QuimiTube, 11 Años Antes
¡Muchas gracias por tus vídeos! Me has ayudado a entender en tan solo un par de horas todo lo que no conseguí entender en meses, realmente muy agradecida 😀 Saludos.
Laura, 11 Años Antes
Hola:
Podrias decirme en que tipos de reacciones la variacion del numero de moles es distinta de cero. Desde ya muchas gracias. Muy interesante y didacto la forma en que se plantean las clases.
Sergio, 11 Años Antes
¡Hola! Te sugiero seguir haciendo los ejercicios, en ellos verás reacciones de este tipo. Cualquier reacción en la que la suma de moles de reactivos y de productos sea distinta te dará una variación de moles distinta de cero. Un saludo.
QuimiTube, 11 Años Antes
muchisimas gracias unas explicaciones clarísimas gracias a ti estoy aprobando los examenes
Alba, 11 Años Antes
Muchas gracias a ti por comentar, ánimo con tus estudios!
QuimiTube, 11 Años Antes
el agua en la reaccion de combustion del metano no deberia de estar en estado lìquido?
lucas lopez, 11 Años Antes
¡Hola! Generalmente se suele poner en estado gas porque durante la combustión se vaporiza, aunque depende de las condiciones de la combustión. A altas temperaturas y en recipientes abiertos (que sería el calor a presión constante, lo más habitual en una combustión) es H2O (g).
QuimiTube, 11 Años Antes
Al final del video, no es trabajo sino calor correcto? Excelentes videos!!
Hector, 10 Años Antes
hola me surge una duda con respecto a calcular el calor liberado. Por ejemplo si tengo la combustión del metano:
CH4 + 202———> CO2 + 2H2O ^(delta)H°= -890.3 kJ/mol
¿que cantidad de calor se libera en la combustion completa de 1.65×10^4 L de CH4 medidos a 18.6 °C y 768 mmHg?
como puedo calcular esto.
Nallely Zavaleta, 10 Años Antes
¡Hola! Debes calcular cuántos moles de metano tienes con esas condiciones usando la ley de los gases ideales, es decir, P·V = n·R·T. Fíjate que tienes la presión (pásala a atmósferas), la temperatura (pásala a kelvin) y el volumen (que ya está en litros). Usando R 0,082 puedes calcular n, que es el número de moles de metano. Una vez calculado el valor de n puedes determinar los kJ liberados, ya que sabes que por cada mol de metano se liberan -890,3 kJ.
QuimiTube, 10 Años Antes
la forma de transmitir el conocimiento es muy buena, un saludo grande!
ivan, 10 Años Antes
¡Muchas gracias y bienvenido!
QuimiTube, 10 Años Antes
eres muy buena explicando , contigo me entero mucho mejor que con mi profesora de quimica que me ha suspendido con 4 el primer trimestre pero con tus explicaciones he logrado sacar un 9 en termodinamica muchas gracias ya que lo que importa no es la materia si no quien te la explique ya que eso influye mucho
yasmina, 10 Años Antes
¡Guau! ¡Un 9! Enhorabuena 😀
QuimiTube, 9 Años Antes
Quiero darte las gracias por tus sosegadas explicaciones.
Transmites seguridad, calma y mucha, mucha sabiduría.
Eres una gran profe.
Javier, 8 Años Antes
Uno de los comentarios más bonitos que me han hecho, muchísimas gracias.
QuimiTube, 8 Años Antes