Contenido del Vídeo
Ya hemos visto en el apartado previo la definición de energía libre, G, que es la máxima energía aprovechable por una reacción química para realizar un trabajo. Asimismo, hemos visto también la relación que guarda la variación de dicha energía libre con la variación de entalpía (ΔH) y la variación de entropía (ΔS) de una reacción química. En este nuevo apartado vamos a ver dos tipos concretos de energías libres de Gibbs, que son la energía libre de Gibbs de formación y la de reacción.
De forma análoga a la entalpía de formación, ΔHfo, que hemos definido en el apartado 10 de teoría de termodinámica, la entalpía libre o energía libre estándar de formación de un compuesto, representada también como ΔGfo, corresponde a la formación de 1 mol de compuesto a partir de sus elementos en estado fundamental. Por ejemplo:
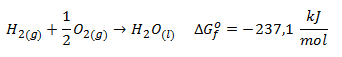
Del mismo modo que ocurre con la entalpía, la energía libre de formación para los elementos puros en estado estándar es cero, por ejemplo:
A continuación vemos una tabla con las energías libres de formación de diversos compuestos:
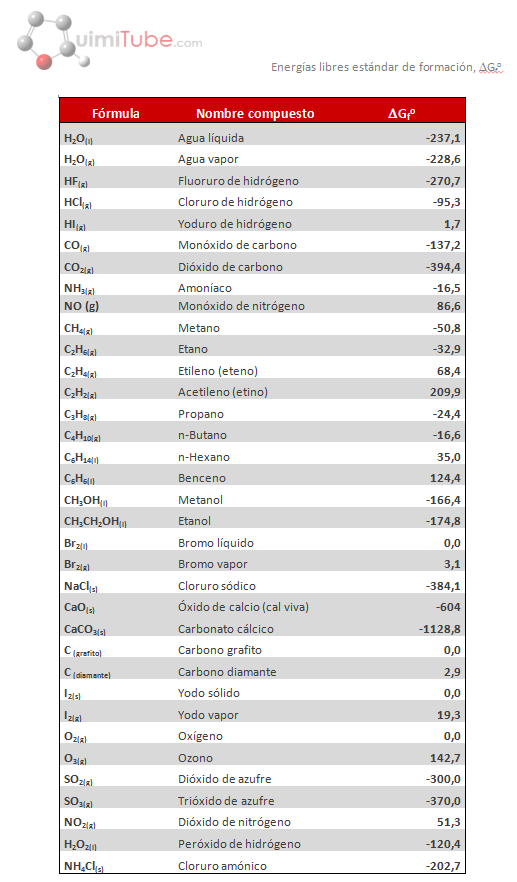
Las unidades de la energía libre de formación son kJ/mol. Los valores se pueden relacionar con la estabilidad de cada compuesto. Cuando menor (más negativo) es el valor de ΔGfo, más estable será dicho compuesto. Si observamos los valores de energías libres de Gibbs de formación estándar (25ºC y 1 atm) de la tabla, el compuesto más estable de estos será el dióxido de carbono (-394,4 kJ/mol) y el más inestable el
Estos valores de energía libre de cada compuesto se pueden emplear para calcular la variación de energía libre de cualquier reacción química, de forma análoga a lo que ocurre con las entalpías de formación. Recordemos la fórmula vista en el apartado 11 de teoría de termodinámica:

Así, para el caso de la energái libre, si tenemos la reacción genérica:
aA + bB → cC + dD
Tendremos:
Energía libre de formación de los reactivos: a·ΔGf(A)o + b·ΔGf(B)o
Energía libre de formación de los productos:c·ΔGf(C)o + d·ΔGf(D)o
ΔGro = Energía libre formación de los productos – Energía libre de formación de los reactivos
ΔGro = c·ΔGf(C)o + d·ΔGf(D)o – a·ΔGf(A)o + b·ΔGf(B)o
Finalmente, y de forma análoga a la entalpía:

Esta fórmula la aplicaremos en los ejercicios resueltos para el cálculo de la energía libre de Gibbs de diversas reacciones químicas.
En el próximo apartado, el apartado 22 de teoría de termodinámica, combinaremos el 20 y el 21 para tener una visión global de qué opciones tenemos para calcular ΔGro, energía libre de Gibbs de una reacción, y cómo predecir de distintas formas la espontaneidad de una reacción química a partir de dichos valores.
Te puede interesar:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
AYUDA!!
CaCO3(s) —-> CaO(s) + CO2 (g)
Tengo que determinar la energía libre de Gibbs, pero no me dieron temperatura.
ΔS = 164.68 J/molK
ΔH= 179.1 J/mol
Ambas son positivas por ende la temperatura es determinante 🙁 Ayuda porfi
Montse, 12 Años Antes
¡Hola! Lo más probable es que precisamente te estén pidiendo que determines a partir de qué temperatura la reacción será espontánea y no espontánea, es decir, en qué casos la energía libre de Gibbs será positiva y en qué casos negativa. Creo que este ejercicio te puede ayudar:
http://www.quimitube.com/videos/termodinamica-ejercicio-35-determinar-el-signo-de-la-energia-libre-con-entalpia-y-entropia/
QuimiTube, 12 Años Antes
Hola!
Pasaba por aquí buscando energías libres y me he encontrado con esta tabla. El problema es que no aparecen las que realmente necesito.
Explico brevemente:
Estoy haciendo un proyecto en Comsol, un programa de simulación, y para una reacción de deshidrogenación del buteno a butadieno necesito la constante de equilibro. Ahora mismo no dispongo de biografía necesaria para ello y no encuentro datos por Internet. Si me podríais decir de dónde habéis sacado esa tabla y si es posible encontrar las que necesito… muchas gracias de antemano =D
Ángel, 11 Años Antes
¡Hola Ángel! Yo las energías libres las he extraído de diversos libros y artículos, recopilando las que los alumnos se encuentran con más frecuencia. Las que tú me comentas son menos habituales, no dispongo de ellas. ¿Has buscado en artículos científicos específicos sobre reacciones de hidrogenación? Quizá ahí lo encuentres… Seguramente en algunos artículos de cálculos computacionales puedas hallar algo de esto. Espero que te sirva. Un saludo.
QuimiTube, 11 Años Antes
Hola,necesito ayuda.
Cómo determinas la diferencia entre (deltaG) y (deltaA) para la reacción C(s) + O2(g) = CO2(g)
Evelyn, 10 Años Antes
¡Hola Evelyn! Pues debes tener como datos la energías libres de formación de cada compuesto (carbono, oxígeno y dióxido de carbono, en tu caso) tal y como explicamos tanto en el vídeo como en el pie de vídeo, por escrito. Te sugiero que lo veas y lo leas con atención, ahí estará mejor explicado de lo que yo pueda decirte por aquí en un comentario. Un saludo grande.
QuimiTube, 10 Años Antes
Que tal, antes que nada muy buenos sus videos, y felicidades a la señorita que los explica, me han servido de mucha ayuda y he aprendido muy bien 😀
Me podrian proporcionar las bibliografias de donde obtuvieron la informacion anterior sobre Energías libres de Gibbs de formación y de reacción ???
Gracias 🙂
Kevin Ivan, 10 Años Antes
Hola Kevin, hemos consultado principalmente en estos libros de 2º de bachillerato, aunque todo el contenido es en realidad de elaboración propia, estos materiales solo se han usado como consulta general:
Química 2 bachillerato McGrawHill
Química 2 bachillerato Editorial Casals
Química 2 bachillerato Santillana
QuimiTube, 10 Años Antes
¡Hola! Tengo una duda…
En un problema me piden calcular ∆G°f de la siguiente reacción:
C(s) + 2H2(g) + 1⁄2 2(g) –> 3(g)
Siendo que no encuentro el valo del C en estado sólido, ese es mi problema.
Andy García J., 10 Años Antes
¡Hola! No entiendo bien la reacción, veo 1/2 2(g) y luego 3(g)… ¿a qué hacen referencia estos números? Un saludo.
QuimiTube, 10 Años Antes
CPNTESTE VERDADDERO O FALSO
a. Las cantidades U, H, A y G tienen todas las mismas dimensiones ( )
b. La relación ∆G = ∆H – T∆S es válida para cualquier proceso ( )
c. G = A + PV ( )
d. En cualquier sistema en equilibrio térmico y mecánico y capaz de realizar solo trabajo P-V, la función de estad G es mínima cuando se alcanza el equilibrio material. ( )
e. La energía de Gibbs de 12 g de hielo 0 °C y 1 atm es menor que la energía de Gibbs de 12 g de agua líquida a 0 °C y 1 atm. ( )
f. Las cantidades SdT, TdS, VdP y VdP tienen todas dimensiones de energía ( )
LEONARDO GONZALEZ BAQUERIZO, 10 Años Antes
Hola Leonardo, como comprenderás no se trata de que nosotros resolvamos tus tareas, sino de que tú intentes hacerlas, veas los vídeos, y si tienes dudas concretas las consultes, pero como te digo concretas. Un saludo y una despedida en tu comentario también sería conveniente.
QuimiTube, 10 Años Antes
En un ehercicio solo tengo entalpia de formacion y energia libre de gibbs de formación me piden calcular la entropia en condiciones estandar
Ayudaa, 10 Años Antes
¡Hola! Tienes que utilizar la relación siguiente:
DG = DH – TDS
Tienes DG, tienes DH y la temperatura como estás en condiciones estándar serán 25ºC que has de pasar a Kelvin.
QuimiTube, 10 Años Antes
Buenas. No me sale este ejercicio:
Muchos hidrocarburos existen como isómeros estructurales, que son compuestos que tienen la
misma fórmula molecular pero diferentes estructuras. Por ejemplo, tanto el butano como el
isobutano tienen como fórmula molecular C4H10. Calcule el porcentaje molar de estas moléculas en
una mezcla en equilibrio a 25°C, a partir de que la energía libre estándar de formación del butano
es de –15.9 kJ/mol y la del isobutano es de –18.0 kJ/mol. ¿El resultado está de acuerdo con el
hecho de que los hidrocarburos de cadena lineal son menos estables que los hidrocarburos con
cadenas ramificada?
Nicolás, 5 Años Antes
¡Hola! ¿Lo has planteado? ¿O no sabes por dónde empezar? Un saludo.
QuimiTube, 5 Años Antes
Me piden que dada
C(g) + O2(g)—–>CO2 (g) determine el cambio de la enegía libre de formación del dioxido de carbono, pero como hago para despejar si no tengo el cambio de energía libre de toda la reaccion,y sacarlo no puedo porque supuestamente no conozco el del CO2 que sería el unico producto
lara, 5 Años Antes
¡Hola! Tendrás que ir a datos tabulados para el CO2, de lo contrario efectivamente es imposible que lo hagas. Si tampoco te dicen temperatura ni presión, yo supondría que estás en condiciones estándar.
QuimiTube, 5 Años Antes