¿Cómo se determinan los valores de pK de un aminoácido?
Escrito por Quimitube el 7 noviembre
Como vimos en una entrada previa, los aminoácidos son moléculas orgánicas que presentan, como su propio nombre indica, un grupo amino y un grupo ácido, en concreto, un grupo carboxilo. Esto hace que tengan un comportamiento anfótero, y que puedan comportarse como ácidos o como bases. Su estructura genérica es:
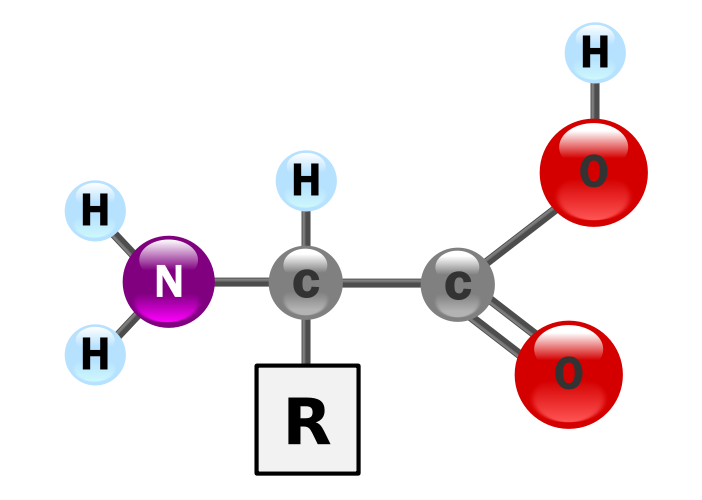
En solución acuosa y a pH fisiológico, un aminoácido se encuentra normalmente como molécula ionizada o ion dipolo, lo que se conoce como zwitterion, en la que el grupo amino gana un protón y adquiere una carga positiva, mientras que el grupo carboxilo pierde el protón y adquiere una carga negativa. En estas circunstancias, la molécula sigue siendo globalmente neutra aunque presenta grupos cargados individuales. Pues bien, como también comentamos en la entrada anterior, cada aminoácido presenta unos valores de pKa que le identifican; es frecuente tener los pK de los grupos ionizables de los aminoácidos en una tabla para poder predecir su comportamiento ácido-base, como la siguiente:
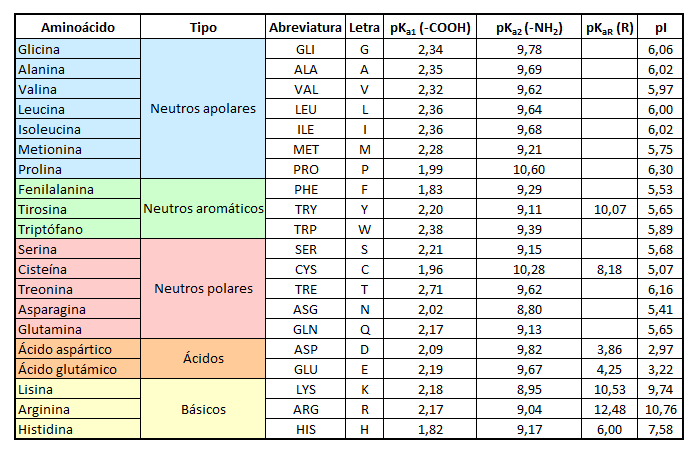
Pero, ¿cómo se calcula? ¿Cuál es la forma experimental en que se pueden determinar los pKa de un aminoácido?
Para determinar los distintos pK de un aminoácido podemos realizar una valoración ácido base, midiendo el pH de la disolución mientras se va titulando y utilizando la gráfica para el cálculo. Para un ácido, a la mitad de su neutralización, el pH medido por el pHmetro corresponde a su pKa. En el caso de un aminoácido podremos determinar dos valores de pK (tal y como vemos en la tabla, y en algunos casos incluso 3) porque hay más de un grupo ionizable. El pK para la desprotonación del grupo amino protonado (cuando está como R-NH3+ y se comporta como ácido) se puede determinar por adición de ácido, mientras que el pK para la protonación del grupo carboxilo (comportándose, por tanto, como una base, al pasar de R-COO- a R-COOH) se puede determinar mediante la adición de un ácido fuerte. En la práctica lo que se hace es preparar una disolución de aminoácido de concentración conocida para saber, desde el principio y por cálculos estequiométricos, cuál es la cantidad de ácido o de base que deberemos agregar para alcanzar el punto de equivalencia de la titulación. Así, se empieza añadiendo ácido (generalmente HCl) para determinar el pKa del grupo carboxílico, R-COOH, y se se continúa después con la adición de base (generalmente NaOH) para determinar el pKa del grupo amino. Al adicionar HCl al aminoácido obtenemos la parte de la curva que queda a la izquierda desde el punto de equivalencia (que coincide con el punto isoeléctrico), y con la posterior adición de NaOH obtenemos la parte derecha.
Como vemos, esta técnica nos permite determinar los valores de pK de los dos grupos ionizables principales (y de otros, si los hubiera, en las cadenas laterales), pero no podemos determinar la concentración de un aminoácido por titulación ácido-base porque los puntos finales para la protonación o desprotonación de la forma zwitteriónica son independientes,así que se determinan por cromatografía líquida de alta resolución, que detallaremos en otra entrada.
Veamos, a continuación, las curvas de titulación de algunos aminoácidos: un aminoácido neutro, un aminoácido básico y un aminoácido ácido.
Determinación de los pKa de un aminoácido neutro: la glicina
Cuando realizamos la valoración de un aminoácido neutro como la glicina, únicamente tenemos dos grupos ionizables, el grupo amino, -NH2, y el grupo carboxílico, -COOH, ya que su estructura es:
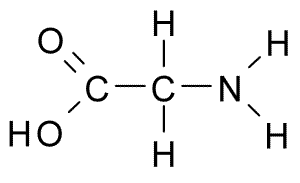
Como su cadena lateral solo es un átomo de hidrógeno, no hay más grupos ionizables que estos. Así, con la valoración ácido base podemos determinar ambos pKa para los grupos comentados. En la imagen, donde se ha representado el pH frente a los equivalentes de OH– agregados, se pueden observar sus valores, pKa de 2,36 para el -COOH y de 9,60 para el -NH2.
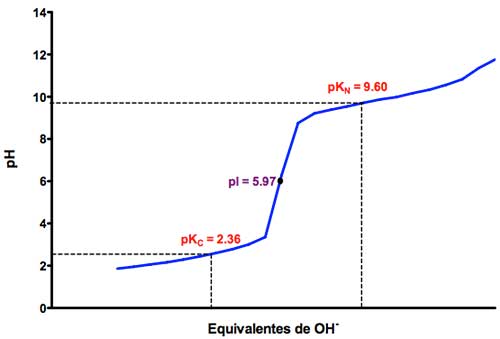
Curva obtenida en la titulación ácido base del aminoácido neutro glicina. Fuente y más información: Departamento de Bioquímica y Biología molecular de la Universidad de Salamanca [1]
Determinación de los pKa de un aminoácido básico: la histidina
Cuando el aminoácido que queremos valorar es básico, presenta un grupo amino adicional en la cadena lateral, que puede comportarse como una base (captando un protón para quedar como -NH3+). Este es el caso de la histidina, que presenta un ciclo con un grupo amino secundario. Su estructura química es la siguiente:
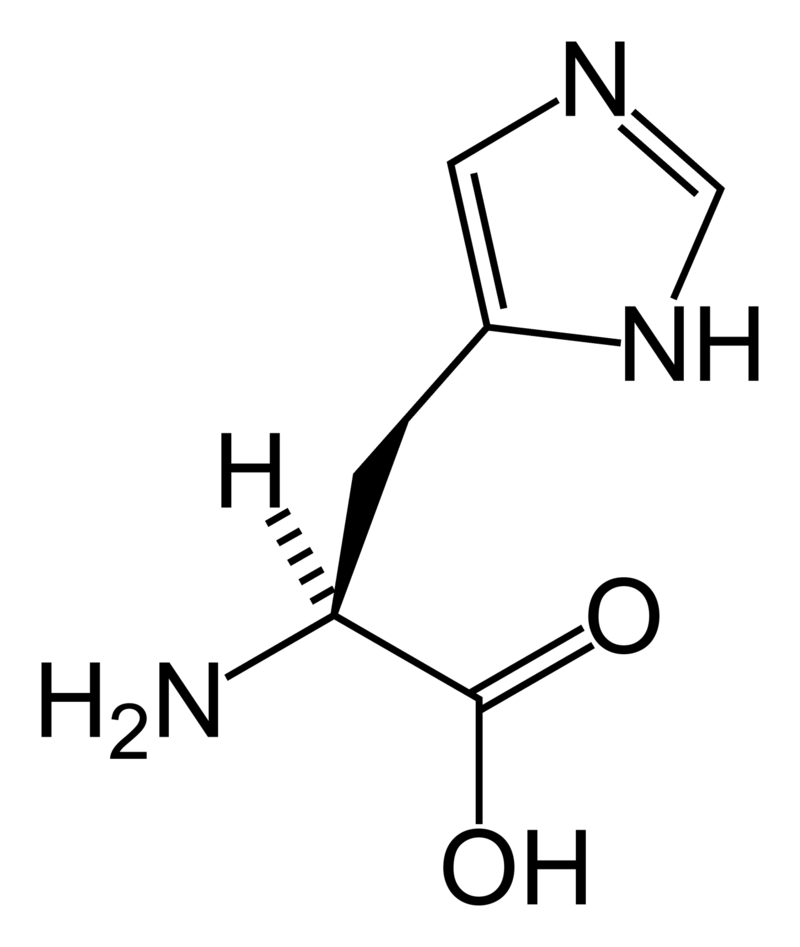
Así, en la curva de titulación de la histidina vemos que los valores de pKa son 3, el primero, de 1,82, para el grupo carboxilo, -COOH. El que aparece rotulado en el gráfico como pKR se corresponde con el valor de pKa de dicho grupo lateral, mientras que el grupo amino del propio aminoácido presentará un pKa de 9,17.
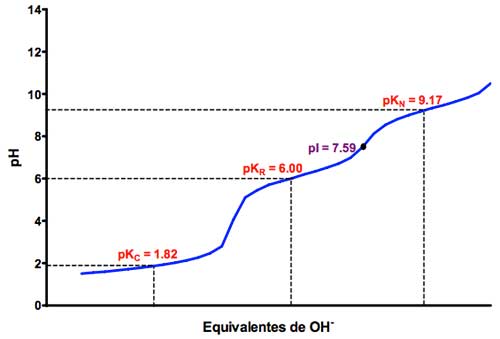
Curva obtenida en la titulación ácido base del aminoácido básico histidina. Fuente y más información: Departamento de Bioquímica y Biología molecular de la Universidad de Salamanca [1]
Determinación de los pKa de un aminoácido ácido: el ácido glutámico
Del mismo modo que ocurre con la histidina, el ácido glutámico, y en general los aminoácidos ácidos, presentan un grupo ionizable adicional en la cadena lateral. En este caso se trata de otro grupo carboxilo, -COOH, como se puede ver en la estructura química de dicho aminoácido:
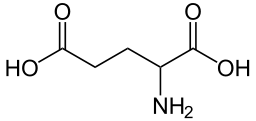
Esto hace que la valoración permita determinar tres valores de pKa, 2,19 para el grupo carboxilo principal, 4,25 para el de la cadena lateral (rotulado como pKR en el gráfico) y de 9,67 para el grupo amino, -NH2. La cercanía de los dos valores hace que en la curva de valoración no estén tan claros los puntos medios para su cálculo:
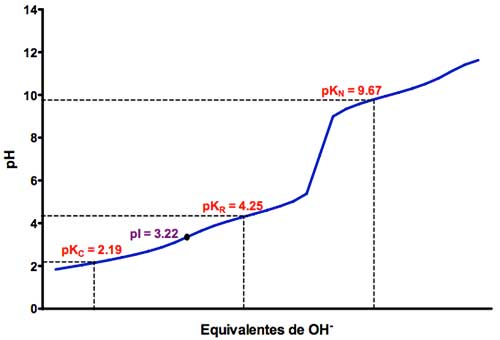
Curva obtenida en la titulación ácido base del aminoácido ácido glutámico. Fuente y más información: Departamento de Bioquímica y Biología molecular de la Universidad de Salamanca [1]
Referencias y más información:
[1] Tema 4. Curvas de titulación de aminoácidos. Departamento de Bioquímica y Biología molecular de la Universidad de Salamanca. Verónica González Núñez.
SKOOG, Douglas. WEST, Donald M. HOLLER, F. James. CROUCH, Stanley R. Química Analítica. 7a ed. México: McGrawHill, 2001. ISBN: 970-10-3358-2.





[…] aminoaciUn aminoácido tiene al menos 2 valores de pKa (del grupo amino y del grupo carboxilo) que se pueden determinar mediante una valoración ácido-base. […]
Cómo determinar los pKa de un amino&aacu..., 10 Años Antes