Disolución de una pastilla efervescente: efecto de la temperatura y del estado de agregación
Escrito por Quimitube el 20 septiembre
A través de Un cacho de ciencia – La ciencia está ahí fuera, (gracias por el descubrimiento) he llegado a este estupendo vídeo de la Real Sociedad Española de Química – Sección Territorial de Murcia colgado en su recién creado canal de Youtube, 100×100 ciencia.
En el vídeo se comprueba el efecto que diversos factores del entorno tienen en la disolución de unas pastillas efervescentes en agua.
- En una primera experiencia, se comprueba de forma cualitativa el efecto de la temperatura con un vaso de agua fría (color azul), otro de agua caliente (color rojo) y otro templada (color morado). La elección de distintos colores para mostrar de forma más visual las distintas temperaturas del agua me ha resultado muy buena idea. Se comprueba que al aumentar la temperatura también aumenta la velocidad de disolución de la pastilla efervescente.
- En la segunda experiencia se comprueba la influencia del estado de agregación de la pastilla en las mismas condiciones de temperatura. Para ello se usan dos vasos con agua fría; en uno de ellos se introduce la pastilla entera y en el otro la pastilla pulverizada en un mortero (esta parte de la experiencia debe ser divertida, siempre me han gustado los morteros). Se comprueba que al pulverizar la pastilla, como aumenta la superficie de contacto entre ésta y el agua, aumenta la velocidad de disolución.
- Por último, en la tercera experiencia, se comprueba el efecto de la temperatura sobre la velocidad de reacción pero de forma cuantitativa, ya que el logaritmo neperiano de la constante de velocidad de un proceso es directamente proporcional a la inversa de la temperatura, según la Ley de Arrhenius:
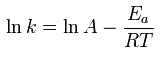
Para determinar esta influencia de forma cuantitativa, se cronometra el tiempo que tarda en disolverse por completo la pastilla efervescente a la vez que medimos la temperatura. Después, si se representa ln (k) frente a 1/T, tendremos una recta cuya pendiente es -Ea/R.
Creo que es una experiencia estupenda para hacer en una clase de secundaria, ya que es una forma fenomenal de que los más jóvenes se inicien en la química.
En fin, lo mejor será que lo veáis vosotros mismos, que una imagen vale más que mil palabras. ¡Muy interesante!





Información Bitacoras.com…
Valora en Bitacoras.com: A través de Un cacho de ciencia – La ciencia está ahí fuera, (gracias por el descubrimiento) he llegado a este estupendo vídeo de la Real Sociedad Española de Química – Sección Territorial de Murcia colgado en su recién cread…..
Bitacoras.com, 12 Años Antes
La solubilidad de los sólidos depende de la temperatura de forma proporcional, al aumentar la temperatura aumenta su solubilidad ( es lo que le pasa al cola-cao al calentar la leche hacemos que aumente su solubilidad y podrá disolverse mas cantidad del sólido en el mismo volumen de disolvente) en este caso la leche, sien embargo a los gases le ocurre lo contrario, la solubilidad de un gas aumenta a medida que disminuye la temperatura ( como en la Coca-cola, cuanto mas fría mas soluble, y mas CO2 disuelto, mas burbujitas,..) Son ejemplos cotidianos del principio de Le Chatelier aplicado a equilibrios de solubilidad,que en el caso de la pastilla esfervescente al aumentar la temperatura aumentamos la solubilidad del solido que forma el comprimido y disminuimos la solubilidad de los compuetos que hacen que el compuesto sea esfervescente, es decir gases probablemente, CO2
http://www.clasesquimicaengranada.webnode.es
antonio castellón, 12 Años Antes
ayuda por favor .no puedo resolver estos ejercicios.
diga el tipo de reaccion quimica y cual es el estado del producto obtenido en la siguiente tabla.:
a) Na(s)+Cl(g) –>
b)HgO(s)—>
c)H2SO4(ac)+Zn(s)–>
yodila figueroa, 5 Años Antes
¡Hola! ¿No tienes más datos? Está un poco incompleto… En la primera reacción se produce NaCl, pero el cloro no es así, sino como diatómico, Cl2. En la segunda, ¿qué es? ¿Una reacción de descomposición? ¿Otro tipo? Y la tercera, siempre que reacciona un ácido con un metal da una sal y se desprende hidrógeno, H2.
QuimiTube, 5 Años Antes