¿Dos isómeros ópticos que huelen distinto? El curioso caso del linalool
Escrito por Quimitube el 20 septiembre
La molécula de linalool, cuyo nombre IUPAC es 2,6-dimetil-2,7-octadien-6-ol (C10H18O), es una sustancia con textura aceitosa, poco densa (en torno a 0,860 g/cm3). De hecho, es lo que llamamos un aceite esencial, es decir, confiere esencia o aroma a algunas plantas. Su estructura es:
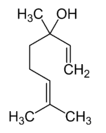
Linalool
Aunque en cierto modo la forma en que está dibujada la estructura puede llevar a engaño a simple vista, no se trata de una molécula cíclica sino de un alqueno de cadena abierta formado por ocho carbonos. En concreto, es un terpeno con un grupo alcohol, -OH, es decir, un derivado del terpeno o isopreno, hidrocarburo de 5 átomos de carbono que puedes ver a continuación:
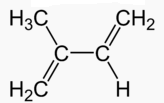
Terpeno o isopreno
Los derivados del terpeno son muy abundantes en la naturaleza. Muchos de ellos, como en este caso, son aceites esenciales presentes en flores y plantas aromáticas. El linalool en concreto presenta un toque mentolado, lo que le ha conferido valor para su uso en productos aromáticos comerciales; se usa en jabones, champús, detergentes… ya que esto da sensación de frescor.
En la naturaleza se halla presente en más de 200 especies de plantas, aunque las más destacables son las familias de las Lamiaceae, como la menta, las Lauraceae, como el laurel y la canela, o las Rutaceae, como los cítricos.
Ahora bien, si observamos con detenimiento la estructura antes indicada del linalool, vemos que presenta un centro quiral. Los sustityentes metilo del carbono al que se halla enlazado el grupo alcohol pueden presentar dos disposiciones distintas, es decir, podemos hallar dos isómeros ópticos o enantiómeros del linalool. Esto quiere decir que tendremos dos moléculas en apariencia idénticas, pero en realidad no lo son; uno de los isómeros del linalool es la imagen especular del otro y, por tanto, no son superponibles.
En concreto, los enantiómeros del linalool reciben, además, nombres distintos:
– El enantiómero S-(+)-linalool recibe el nombre de licareol.
– El enantiómero R-(-)-linalool recibe el nombre de coriandrol.
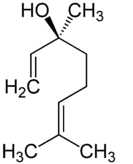
S-(+)-linalool: licareol
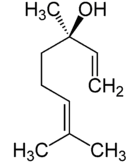
R-(-)-linalool: coriandrol
Como vemos, en efecto, se trata de dos moléculas “reflejadas”, como ocurre con la mano izquierda y la mano derecha, o con nuestra imagen en el espejo y nosotros mismos (¿alguna vez os habéis fijado en que, si sois diestros, en el espejo sois zurdos y viceversa?).
Pero lo más curioso de esta molécula no es que presente dos isómeros ópticos (¡esto es tremendamente frecuente en la naturaleza!), sino que cada enantiómero evoca distintas sensaciones en nuestro cerebro (no soy experta en bioquímica, pero imagino que esto implica que a pesar de su semejanza ambas estructuras activan receptores distintos; quizá algún lector pueda corregir o puntualizar este hecho).
Es decir, cada enantiómero huele distinto. La molécula S-(+)-linalool, licareol, presenta un olor dulzón, floral y con un toque de limón, mientras que a molécula de R-(-)-linalool, coriandrol, presenta un aroma entre madera y lavanda.
Qué sorprendente es la química, ¿verdad? Un cambio en apariencia tan pequeño que tiene consecuencias tan apreciables. Ahora que sabéis cómo huele cada uno de ellos: ¿qué isómero del linalool preferís? ¿El licareol o el coriandrol?





Otro ejemplo, muy cercano para todos, de isómeros ópticos que huelen diferente es el Limoneno.
El isómero R-Limoneno huele a naranja y el isómero L-Limoneno a limón. Seguro que todos lo hemos experimentado muchas veces. La química es fantástica. Un saludo.
Anaquimi, 12 Años Antes
Muchas gracias por el aporte y bienvenida 😀
QuimiTube, 12 Años Antes
En la naturaleza se encuentran los dos isómeros de la carvona: 2-metil-5-(1-metiletil)-2-ciclohexenona, el olor característico de la alcaravea y de las semillas de eneldo se debe a uno de lo dos enantiómeros mientras que el aroma de la menta se debe al otro, un saludo
antonio, 12 Años Antes
Hola Antonio, gracias por el apunte y bienvenido, tendré que hacer una lista de isómeros que cumplen estas característica 🙂 Un saludo
QuimiTube, 12 Años Antes
[…] […]
Polímeros de adición: el caucho natural y el caucho sintético | Quimitube, 12 Años Antes
En la naturaleza se encuentran los dos isómeros de la carvona: 2-metil-5-(1-metiletil)-2-ciclohexenona, el olor característico de la alcaravea y de las semillas de eneldo se debe a uno de lo dos enantiómeros mientras que el aroma de la menta se debe al otro, un saludo
www.clasesquimicaengranada.webnode.es, 12 Años Antes