¿Quién vive en clatratos al fondo del mar? ¡El metano!
Escrito por Quimitube el 13 enero
El hecho de que al gas metano se le conozca desde mucho antes que la propia estructura química de los compuestos, ha hecho que a lo largo de la historia haya recibido nombres distintos, generalmente en función de su procedencia, a pesar de tratarse siempre del mismo compuesto. Tal vez os resulten familiares los nombres de «gas grisú», gas inflamable y peligroso que se produce en las minas de carbón, «gas de los pantanos» o «gas natural», este último utilizado para obtener energía en los hogares. En su mayor parte (pueden contener pequeñas proporciones de otros compuestos) todos ellos son CH4, un gas ligero de un átomo de carbono cuyas moléculas presentan una estructura tetraédrica, en la que el carbono es el átomo central y se une a los cuatro átomos de hidrógeno mediante enlaces covalentes:
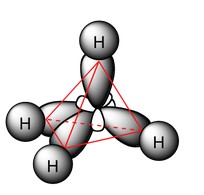
Los enlaces carbono-hidrógeno tienen una longitud aproximada de 109 pm, mientras que sus ángulos son de 109,5º. Podríamos dibujar el tetraedro de la molécula circunscrito en una esfera que tendría un radio equivalente a dicha longitud de enlace (aunque habrá que tener en cuenta el radio del átomo de carbono, pero como aproximación nos sirve visualizarlo de este modo).
Su presencia en la naturaleza es muy habitual en aquellos lugares en los que se produce una descomposición anaerobia (sin presencia de oxígeno) de la materia orgánica junto con otros procesos. Así se formaron los depósitos de gas natural, también en los pantanos y en las explotaciones ganaderas, dentro de esos reactores bioquímicos que son los aparatos digestivos de los rumiantes y otros mamíferos. Por ejemplo, las vacas producen una cantidad de metano nada desdeñable; en estas explotaciones se puede producir también a partir del estiércol, utilizando determinadas bacterias y recibiendo el nombre de biogás: además, la obtención de este biogás produce también un subproducto que se puede utilizar como fertilizante.
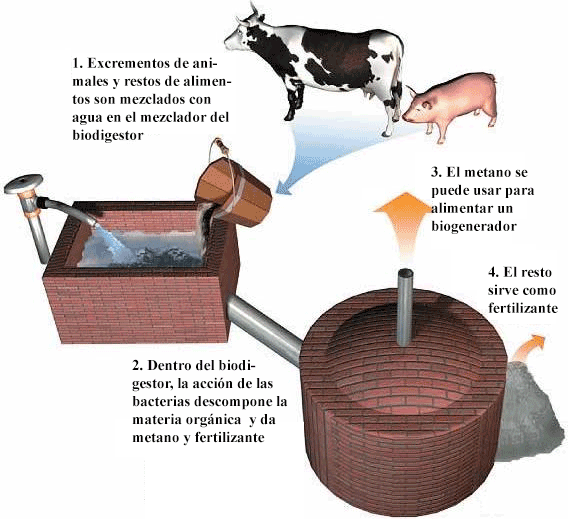
Producción de metano y de residuos fertilizantes a partir de estiércol utilizando un sencillo biodigestor en una explotación ganadera. Fuente: Wikipedia. Dominio público.
Pero existe otra fuente de metano en la naturaleza probablemente mucho menos conocida. Se trata del metano atrapado en el hielo del fondo oceánico, procedente, según se cree, de la reducción microbiana de CO2 [1]. En la imagen siguiente se puede ver una estructura de hielo que se mantiene unida mediante enlaces de hidrógeno; cabe decir, no obstante, que hay distintas estructuras para el hielo con ligeras modificaciones entre sí, pero todas ellas presentan cavidades similares; esta nos sirve como ejemplo:
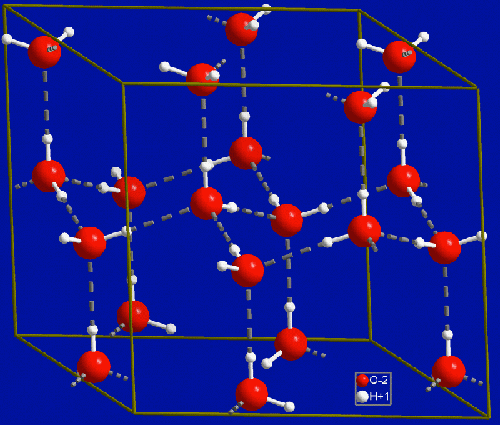
Estructura del hielo por formación de enlaces de hidrógeno regulares entre las distintas moléculas de agua. La estructura es similar a la del diamante y podemos encontrar huecos en los que se incluyen moléculas de metano. Fuente: Wikipedia. Dominio público.
Esta estructura del hielo, con cavidades regulares, hace que pueda formar clatratos y encerrar dentro de sí moléculas de pequeño tamaño, como es el caso del metano. Ya hemos indicado previamente que una molécula de metano se puede considerar de forma aproximada como una esfera con radio 109 pm (además del hidrógeno), lo cual hace que tenga cabida en los huecos del hielo. En este, la distancia aproximada entre los dos átomos de oxígeno más cercanos es de 275 pm. A este clatrato de hielo y metano se le conoce con el nombre de hidrato de metano, y se forma a las bajas temperaturas y elevadas presiones del fondo oceánico (con estequiometría CH4·5,75H2O, lo que implica 4 moléculas de metano por cada 23 moléculas de agua). A continuación se muestra el diagrama de fases de los hidratos de metano, donde se representan las condiciones de presión y temperatura a partir de las cuales podemos encontrar dichas estructuras (indicado en color verde como «Methane Hydrate & ice».
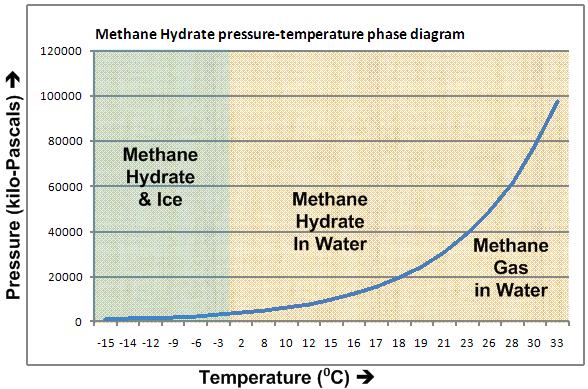
Diagrama de fases de los hidratos de metano. Fuente: Wikipedia. Dominio público.
Aunque se desconoce cuál es la cantidad real de metano que se encuentra encerrado en los clatratos, se estima que puede ser del orden del billón de toneladas. Por tanto, el hielo en su estructura cristalina encierra a las moléculas de metano, que son incapaces de escapar y de liberarse al agua de los océanos y posteriormente a la atmósfera, pero… ¿qué pasaría si parte de ese hielo dejase de ser hielo a causa del aumento de temperatura terrestre? El problema no es en absoluto desdeñable, ya que el metano es un gas capaz de producir un efecto invernadero muchísimo más potente que el dióxido de carbono (23 veces más potente para 1 gramo de gas), el cual de por sí ya nos preocupa bastante [2].
Esta suposición se conoce como la “hipótesis del fusil de clatratos” [4], la cual sugiere que el aumento de temperatura del planeta por el calentamiento global podría hacer que el metano de los sedimentos oceánicos se liberase a la atmósfera de forma repentina. La hipótesis también sugiere que esta podría ser la causa del rápido calentamiento global ocurrido en el pasado lejano de la Tierra, hace 55 millones de años, cuando se produjo un máximo térmico considerable. Dada la importancia de estos depósitos, existen desde hace tiempo y en la actualidad muchos equipos de investigación que intentan averiguar la cantidad global de metano en los sedimentos oceánicos, la velocidad a la que se libera y el efecto que tiene sobre él el calentamiento global, como [1] y [4]. Incluso se piensa que se podrá utilizar esta fuente de metano como fuente de energía en no muchos años y, de hecho, Japón lo consiguió ya en el año 2013 [5]. Si estamos ante una nueva amenaza para la sostenibilidad ambiental del planeta, ante una nueva fuente de energía disponible o ante ambas cosas, los años venideros lo revelarán.
Referencias:
- A review of the geochemistry of methane in natural gas hydrate
- Direct Global Warming Potentials (mass basis) relative to carbon dioxide
- Methane Hydrates in Quaternary Climate Change: The Clathrate Gun Hypothesis
- Global inventory of methane clathrate: sensitivity to changes in the deep ocean
- Japan extracts gas from methane hydrate in world first




