Contenido del Vídeo
Calcularemos nuevamente el pH de la misma disolución reguladora del ejercicio 19 por la ecuación de Henderson-Hasselbach (teoría 7: soluciones amortiguadoras). Veremos que es mucho más sencillo.
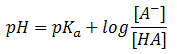
El enunciado del ejercicio es:
Calcular, a 25ºC, el pH de una disolución obtenida al disolver 0,8 moles de ácido acético y 0,8 moles de acetato de sodio hasta obtener un litro de disolución.
Category: Ejercicios resueltos ácido base y Vídeos Ácido base.
Etiquetas: Soluciones amortiguadoras o reguladoras.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Muchísimas gracias, me has ayudado a entender muchísimo de cómo se debe plantear la ecuación; ya me encargué de divulgar tu Quimitube en mi generación porque está genial, saludos desde la Facultad de Medicina de la UASLP, Méx. Reitero, GRACIAS!
Erandi Espinoza, 13 Años Antes
Hola Erandi, bienvenido 🙂 Me alegro de que se entiendan los conceptos ya que me gusta que la química sea entendida y, si es posible, disfrutada. Te agradezco profundamente que nos divulgues porque ahora mismo es lo que más necesitamos para continuar avanzando, ¡gracias, de verdad!
Un gran saludo,
Carmen
QuimiTube, 13 Años Antes
Por supuesto que sí, me agradaría mucho que nos ilustraras con algunos problemas de energía Libre de Gibbs en las que se utilizan constantes de disociación y concentraciones, en realidad tengo vagando estos conceptos porque jamás los aprendí bien.
Erandi Espinoza, 13 Años Antes
más orientado a la bioquímica jeje
Erandi Espinoza, 13 Años Antes
Lo lamento, pero esos conceptos serán más adelante, porque son de nivel universitario y todavía no vamos a grabar a estos niveles, aunque llegará, eso sí…
QuimiTube, 13 Años Antes
Eso seria genial! Espero que muy pronto grabéis esos vídeos!
Vanessa, 12 Años Antes
Hola, ¿las concentraciones que ponés en el logaritmo son las inicales porque la constante de acidez es muy chica y hace que las iniciales sean casi iguales que las del equilibrio?
Muchas gracias por el video.
PD: varias veces tuve problemas para agregar algún comentario, creo que habría que revisar si la página funciona bien.
Guillermo, 12 Años Antes
¡Hola de nuevo! Siempre se ponen las iniciales, al incluir el valor de la constante en la ecuación ya se tiene en cuenta la disociación que se producirá, así se hace más sencillo. Si tuvieses que calcular las concentraciones de equilibrio la ecuación no te aportaría ninguna simplificación, así que las iniciales, siempre, independientemente de la magnitud de su constante de acidez. Un abrazo.
QuimiTube, 12 Años Antes
ayudeme porfavor.. con este probema!!!
cuen su laboratorio cuenta con las siguientes bases:
dimetilamina,piridina,hidroxilamina,trimetilamina,siquiere preparar un buffer de PH=10 cual de estas bases seleccionaria?¡?¿
ANALIS, 12 Años Antes
¡Hola Analis! Yo buscaría las constantes de basicidad de esos compuestos que indicas y usaría la que tenga un valor de Kb más próximo a 10.
QuimiTube, 12 Años Antes
sei bella in piu intelligente grazie per la dimostracione
william, 11 Años Antes
¡Gracias!
QuimiTube, 11 Años Antes
Excelente explicacion, estudio Ingenieria quimica y he visto tus videos, me has ayudado a aprobar las quimicas generales y ahora me ayudan tus videos a aprobar mis cursos de quimica analitica. Espero q puedas extenderte a quimica organica y bioquimica!
Muchisimas gracias! Saludos desde Guatemala.
Becca, 11 Años Antes
Hola Becca, muchísimas gracias, me alegra que te sirvan 🙂 Espero poder extenderme, aunque será más adelante, en unos meses. Muchas gracias de nuevo y un saludo hasta Guatemala.
QuimiTube, 11 Años Antes
Ayuda… 548mg de acetato de sodio en 100mL de solucion. Calcular el Ph
carolina, 11 Años Antes
Hola Carolina, debes calcular la molaridad de la disolución pasando los miligramos a moles. Cuando tengas la concentración molar procedes como en cualquier otra base débil, pero con el anión acetato, CH3COO-. Será similar a este ejercicio con amoníaco:
http://www.quimitube.com/videos/ejercicio-3-calculo-del-ph-de-un-acido-debil-a-partir-del-valor-de-ka/
Necesitarás conocer también la Kb del acetato.
Un saludo.
QuimiTube, 11 Años Antes
Y la temperatura??
Jossy, 10 Años Antes
¡Hola! Es muy frecuente en los ejercicios en los cuales hay constantes de equilibrio (como es el caso de ácido-base) que te den la temperatura, aunque no la uses, porque los valores de Ka dependen de la misma y así si tienes que mirar en una tabla, por ejemplo, sabes que tiene que ser en esas condiciones.
QuimiTube, 10 Años Antes
Hola, me dieron un ejercicio que dice… Calcular el pH de una solucion CH3COOH a,300 M y CH3COONa 0,100M Ka: 1.8×10-5
y luego en otra consigna dice… Calcular el pH despues del agregado de 0,0200 mol de HCL a 500mL de Solucion. Y no se como resolver esa segunda parte.
Mari, 10 Años Antes
Hola Mari, cuando tú agregas una cierta cantidad de ácido, lo que tienes es que inicialmente en lugar de no tener nada de H+, sí tienes de partida una cierta cantidad, en concreto los 0,02 moles procedentes de la disociación del HCl. Así, debes hacer el ejercicio tal y como hacemos este, por equilibrio:
http://www.quimitube.com/videos/ejercicio-19-calculo-del-ph-de-una-solucion-amortiguadora-por-equilibrio
Pero en lugar de poner 0 en H3O+ inicial pondrás su concentración (0,02 moles en 500 mL, te recomiendo pasarlo a molaridad, moles/litro).
Espero que esta orientación te sirva.
Un saludo
QuimiTube, 10 Años Antes
hola!!! tengo una duda, como sacas de resulatdo pH=4,75? cuando pongo en la calculadora -log1,79×10`(-5) me sale otro resulatado diferente al tuyo, espero que me puedas resolver ésta duda.
gracias por tus videos me estan ayudando muchisimoo!!! un saludo
Lorenzo, 10 Años Antes
¡Hola! A lo mejor no has puesto paréntesis y te ha calculado primero el logaritmo de 1,79, y luego el resultado de esto lo ha multiplicado por 10(-5). Yo pongo -LOG(1,79E-05)
QuimiTube, 10 Años Antes
Hola, tengo una duda con un ejercicio de la escuela, he podido realizar la primera parte pero no se como realizar la segunda, agradecería si me pudieras orientar, el ejercicio dice así: Se tiene 1 lt de una sc de CH3COONa 2×10^-2 (KH 5,55×10^-10) A esta sc se le agregan 2×10^-3 moles de HCl, calcular el pH antes y después del agregado de dicho ácido. Como te comente pude sacar el pH de antes del agregado, me dio pH= 8,52 pero no entiendo como sacarlo después D:
micaela, 10 Años Antes
¡Hola! Lo harías del siguiente modo, planteas el equilibrio de protonación del acetato:
CH3COO- + H2O = CH3COOH + OH-
Cuando agregas el ácido, los protones procedentes del ácido van a neutralizar una cantidad equivalente de OH-, lo que desplazará el equilibrio anterior y modificará el pH. A ver si con esta orientación puedes plantear algo y si no ya comentamos más a fondo. Un saludo grande.
QuimiTube, 10 Años Antes
Por favor necesito la formulas para calcular el PH Y POH de las soluciones Amartiguadoras?.-
Eneida, 10 Años Antes
Hola Eneida, usa esta misma fórmula, la de Henderson-hasselbalch tal y como la utilizamos en este vídeo.
QuimiTube, 10 Años Antes
Hola:
En las soluciones amortiguadoras, ¿es siempre despreciable la concentración de sal proveniente de la disociación del ácido frente a la concentracion de sal que es añadida desde principio?
Otra duda:¿Se comportaría como solución amortiguadora una solución formada por ácido acético y otra sal que no fuese su base conjugada, por ejemplo, se me ocurre benzoato de sodio?
Belén, 10 Años Antes
Ah! GRACIAS! 🙂
Belén, 10 Años Antes
Hola tu material me ha servido muchísimo, pero de casualidad tienes algún vídeo en el que se preparen soluciones amortiguadoras con ácidos polipróticos.
gracias
Cristian, 9 Años Antes
Hola Cristian, lo lamento, no tengo ninguno. Un saludo.
QuimiTube, 9 Años Antes