Contenido del Vídeo
En este vídeo vamos a resolver un ejercicio de química de Selectividad de Andalucía, de la convocatoria de junio de 2013; en concreto, se trata del ejercicio 5 de la opción A. El enunciado completo es el siguiente:
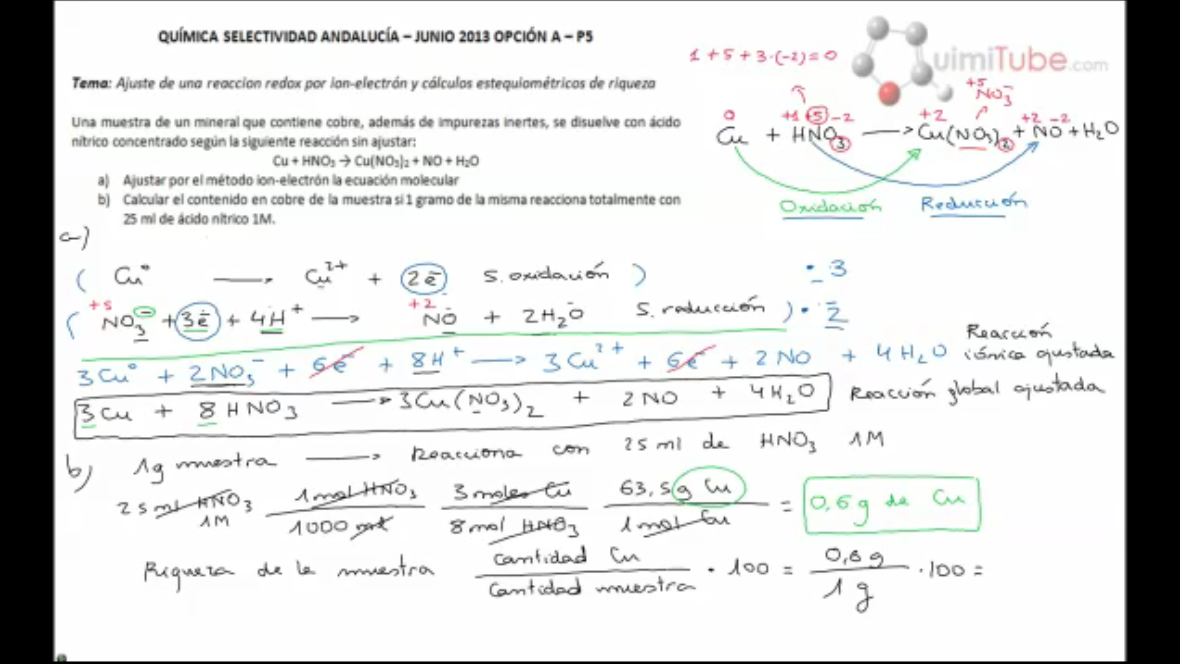
Una muestra de un mineral que contiene cobre, además de impurezas inertes, se disuelve con ácido nítrico concentrado según la siguiente reacción sin ajustar:
Cu + HNO3 -> Cu(NO3)2 + NO + H2O
a) Ajustar por el método del ion-electrón la ecuación molecular.
b) Calcular el contenido en cobre de la muestra si 1 gramo de la misma reacciona totalmente con 25 ml de ácido nítrico 1M.
Por tanto, en primer lugar, vamos a ajustar la reacción. Para ello debemos averiguar primero los estados de oxidación de los distintos elementos que intervienen en la reacción; de este modo, sabremos que el elemento que se oxida es aquel cuyo estado de oxidación aumenta, y el elemento que se reduce aquel cuyo estado de oxidación disminuya. Como veremos con detenimiento, el cobre pasa de un estado de oxidación 0 a un estado de oxidación +2, por lo que se está oxidando; el nitrógeno pasa de un estado de oxidación +5 a un estado de oxidación +2, por lo que se está reduciendo.
Una vez ajustada la reacción, realizaremos unos cálculos estequiométricos muy sencillos en base a ella para determinar el contenido total en cobre de una muestra de 1 gramo. Debemos tener en cuenta que la masa total de la muestra no se empleará en el cálculo estequiométrico, ya que además de cobre contiene otras sustancias inertes; únicamente la emplearíamos si nos pidieran la riqueza, la cual nosotros calcularemos a modo de ejemplo, pero en el enunciado de selectividad no nos están pidiendo calcularla.
Category: Ejercicios Selectividad.
Etiquetas: Ajuste de reacciones Redox y Estequiometría.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
podrías hacer algún ejercicio de redox que incluyese estequiometría pero sin hacerlo del modo de factores de conversión? es que no los entiendo 🙁
luna, 11 Años Antes