Contenido del Vídeo
Imaginemos que tenemos un recipiente con 1 litro de agua y vamos agregando cloruro sódico, sal común, de forma que se va disolviendo:
NaCl(s) → Na+(aq) + Cl–(aq)
Seguimos añadiendo y añadiendo sal y agitando hasta que llega un momento en el que la disolución es incapaz de disolver más sal y esta empieza a depositarse en el fondo del recipiente como sólido, fenómeno que recibe el nombre de precipitación. Se dice, además, que se trata de una disolución saturada.
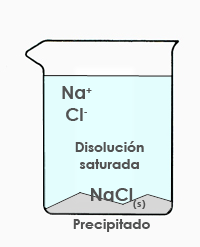
Es decir, una disolución saturada es aquella que no puede disolver más cantidad de un determinado soluto.
La máxima cantidad de una sal que se puede disolver en un litro de un disolvente, generalmente agua, se denomina solubilidad, y depende de la sal que estemos disolviendo. Se suele indicar en gramos/Litro (g/L) o en molaridad (mol/L). Por ejemplo, en agua y a 25ºC:
Solubilidad del NaCl: 359 g/L = 6,14M
Solubilidad del AgCl: 0,0052 g/L = 3,63·10-5 M
Como vemos, la diferencia entre la solubilidad de ambas sales tomadas como ejemplo, NaCl y AgCl, es muy grande. Así, en función de su solubilidad, las sales se pueden clasificar como:
- Solubles, si s > 0,02 mol/L
- Ligeramente solubles, si s ≅ 0,02 mol/L
- Poco solubles, si s < 0,02 mol/L
A estas últimas, en ocasiones se las denomina insolubles, aunque todas las sales se disuelven en cierta medida, aunque sea muy muy poco.
Para estas sales poco solubles se puede plantear el equilibrio químico siguiente cuando se tiene una disolución saturada:
AnBm(s) ⇔ nAm+ (aq) + mBn- (aq) Equilibrio de solubilidad
Equilibrio que recibe el nombre de equilibrio de solubilidad.
Como vemos, un equilibrio de solubilidad es un equilibrio heterogéneo, en el que tenemos una fase sólida, AnBm(s), y una fase disuelta, Am+(aq) y Bn-(aq). Por tanto, en la constante de equilibrio no se tendrá en cuenta el sólido, sino únicamente los iones disueltos; a la constante de equilibrio de un equilibrio de solubilidad se la denomina producto de solubilidad, Ks:
Ks = [Am+]n·[Bn-]m Producto de solubilidad
Tabla de productos de solubilidad a 25ºC de distintas sales poco solubles en PDF
Si [Am+]n·[Bn-]m < Ks, tenemos una disolución insaturada. Se disuelve toda la sal y se podrá seguir disolviendo más. El sistema no está en equilibrio y no se forma precipitado.Si tenemos un sistema en el que desconocemos su estado, podemos comparar su valor con el producto de solubilidad para predecir su evolución del mismo modo que hacemos con Qc en un equilibrio químico homogéneo. Así:
Si [Am+]n·[Bn-]m = Ks, el sistema está en equilibrio y no se produce precipitado. La disolución está saturada.
Si [Am+]n·[Bn-]m > Ks, la disolución está sobresaturada y precipita cierta cantidad de sólido en el fondo del recipiente, quedando el sistema en equilibrio.
Relación entre la solubilidad y el producto de solubilidad
Aunque el valor de s y Ks para una sal no son lo mismo, conociendo uno se puede calcular el otro. Así:
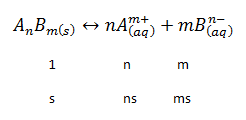
Cuando se disuelve 1 mol de AnBm, se forman n moles de Am+ y m moles de Bn-. Cuando se disuelven s moles, es decir, el valor de la solubilidad de la sal, se forman sn moles de Am+ y sm moles de Bn-. Así, el producto de solubilidad será:
[Am+] = sn
[Bn-] = sm
Ks = [Am+]n·[Bn-]m
Ks = (sn)n·(sm)m
Donde:
n: coeficiente estequiométrico del catión Am+
m: coeficiente estequiométrico del anión Bn-
Por ejemplo:
Sal de tipo AB
Ejemplo: cloruro de plata, AgCl
AgCl(s) ⇔ Ag+(aq) + Cl–(aq)
Ks = (sn)n·(sm)m
n = 1; m = 1
Ks = s·s = s2
Sal de tipo AB2
Ejemplo: yoduro de plomo(II), PbI2
PbI2(s) ⇔ Pb2+(aq) + 2I–(aq)
n = 1; m = 2
Ks = s·(2s)2 = 4s3
Sal de tipo AB3
Ejemplo: hidróxido de aluminio, Al(OH)3
Al(OH)3 ⇔ Al3+(aq) + 3OH–(aq)
n = 1; m = 3
Ks = s·(3s)3 = 27·s4
En los ejercicios resueltos veremos cómo usar Ks para calcular s y viceversa.
Category: Vídeos Equilibrio Químico.
Etiquetas: Equilibrio de solubilidad.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
es muy bueno
omar lopez, 10 Años Antes
No sé como lo haces, pero eres muy práctica, lo entiendo todo a la primera, !muchas gracias por invertir tu tiempo aquí!
teresa, 9 Años Antes
Muchas gracias a ti por invertir tu tiempo para dejar un comentario de ánimo 🙂 Un saludo grande.
QuimiTube, 9 Años Antes
Que relacion hay entre el equilibrio de solubilidad y el equlibrio de precipitation?
JAVIER ASO ROCA, 9 Años Antes
Si consideras la disolución de una sal desde el sólido como el equilibrio de solubilidad, y la precipitación de dicha sal desde los componentes disueltos como el equilibrio de precipitación, entonces serían dos equilibrios inversos para el mismo fenómeno.
QuimiTube, 9 Años Antes
Eres súper buena, gracias a ti he mejorado mi conocimiento
Omar AM, 8 Años Antes