Contenido del Vídeo
Veremos la relación cuantitativa que existe entre la constante de acidez de un ácido débil genérico HA, Ka, y la constante de basicidad, Kb, de su correspondiente base conjugada A–. Para ello, plantearemos los dos equilibrios implicados, es decir:
- Equilibrio de disociación del ácido HA:
HA(aq) + H2O(l) <–> A–(aq) + H3O+(aq)
- Equilibrio de protonación de la base conjugada A–:
A–(aq) + H2O(l) <–> HA(aq) + OH–(aq)
Y plantearemos la constante de acidez, Ka, constante de basicidad, Kb, del segundo. Si multiplicamos ambas constantes vemos que se van simplificando términos que se hallan en el numerador y en el denominador, de forma que, finalmente, obtenemos:
Ka·Kb= [H3O+][OH–]
Es decir: Ka·Kb = Kw
Por tanto: el producto de la constante de acidez de un ácido y de la constante de basicidad de su base conjugada, es igual al producto iónico del agua.
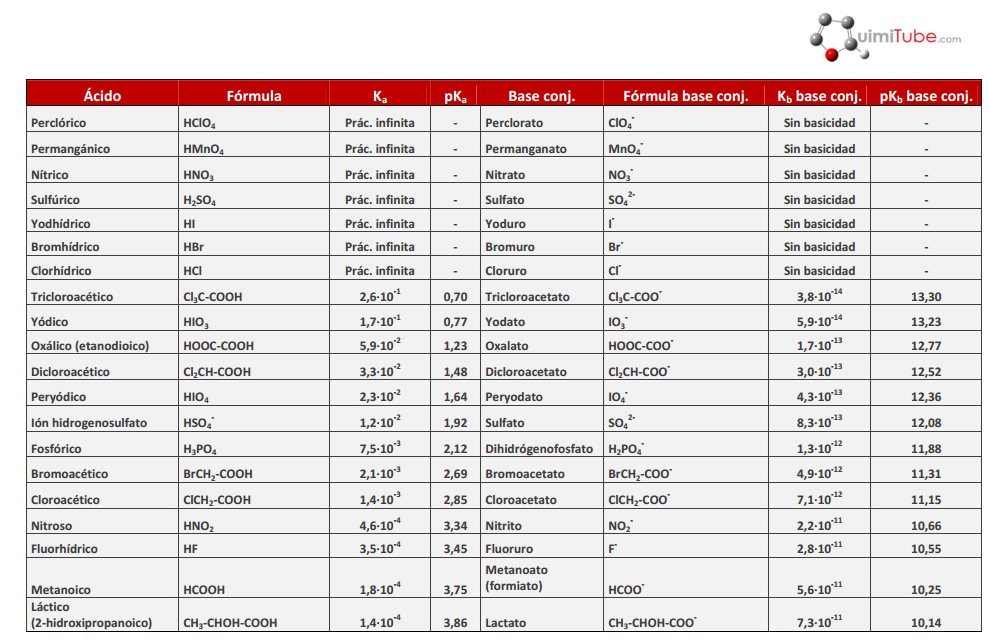
A continuación tienes en PDF una Tabla de Constantes de Acidez y Basicidad
También puede verla como imagen:
Category: Teoría ácido base y Vídeos Ácido base.
Etiquetas: Conceptos de equilibrio ácido-base y Constantes de acidez y basicidad.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
el Kw varía con la temperatura?
Diana, 11 Años Antes
Hola Diana, bienvenida. Sí, es una constante de equilibrio y como tal varía con la temperatura. Aquí tienes un ejercicios donde se trabaja este concepto:
http://www.quimitube.com/videos/ejercicio-13-variacion-del-producto-ionico-del-agua-con-la-temperatura/
Un saludo y gracias por comentar.
QuimiTube, 11 Años Antes
¿Qué es pKa?
Ana, 10 Años Antes
¡Hola! Es -log(Ka) es decir, logaritmo negativo de la constante de acidez, del mismo modo que pH es logaritmo negativo de la concentración de H+.
QuimiTube, 10 Años Antes
Como relacionamos a las constante s con el PH ?
lucia, 10 Años Antes
¡Hola! Ambas constantes dependen de la concentración de H3O+, y con dicha concentración, haciendo -log[H3O+], calculas el pH. Te sugiero hacer ejercicios al respecto, tenemos muchos resueltos. Un saludo.
QuimiTube, 10 Años Antes
Hola, tengo una duda. ¿Podemos decir que cuanto mayor es la Kb, el compuesto es más base y lo mismo con los ácidos y la Ka? ¿Que compuesto sería más base Kb = 3,6*10^(-4) o Kb = 1,8*10^(-5)?
Saludos.
Albert, 9 Años Antes