Contenido del Vídeo
En este ejercicio resuelto de termodinámica vamos a calcular la entalpía de reacción en la producción industrial de ácido nítrico a partir de las entalpías de formación de los distintos compuestos que intervienen en la reacción, que son el dióxido de nitrógeno, el agua, el ácido nítrico y el monóxido de nitrógeno.
La siguiente reacción tiene lugar en la etapa final de la producción de ácido nítrico:
A partir de los datos siguientes, calcular la variación de entalpía para dicha reacción:
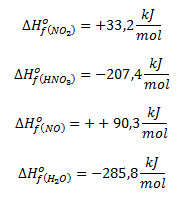
Para ello usaremos la fórmula vista en teoría:

Tal vez también te interese:
Calcular la entalpía de descomposición del carbonato cálcico con las entalpías de formación
Calcular la entalpía estándar de formación del cloruro potásico por estequiometría
Calcular la variación de entalpía de la reacción del HCl con el oxígeno
Y también:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Ejercicios de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola me encanta su sitio, quiero comentar que el ejercicio #16 formación de HNO3, lo resolví y no da, en la sumatoria de reactivos hay un signo (-) que considero no debe de ir, debería decir así:
[2(-207.4) + 1(190.4) – [3 (33.2) + 1(-285.8)]. = 791.7 kJ
Saludos y felicidades.
Alma Delia, 11 Años Antes
¡Hola! Muchas gracias por tu apoyo y comentario 🙂 Estoy comprobando resultados y no logro que me dé ese valor, 791,7 kJ… En todo caso me da el que hemos calculado en el ejercicio… Un saludo.
QuimiTube, 11 Años Antes
[…] A partir de datos estándar de formación: http://www.quimitube.com/videos/termodinamica-ejercicio-16-entalpia-de-reaccion-en-la-produccion-ind… […]
Clases sobre Termoquímica | qca.scs, 9 Años Antes