Contenido del Vídeo
Si bien la regla del octeto es muy útil para la determinación de la estructura de Lewis de algunas moléculas sencillas, en especial aquellas que están formadas por átomos no metálicos del segundo período (por ejemplo oxígeno, carbono, nitrógeno…), lo cierto es que existen excepciones a la misma. Estas excepciones pueden ser por defecto y por exceso.
Las excepciones por defecto implican que puede haber átomos enlazados covalentemente que se rodeen de menos de ocho electrones. Por ejemplo, el boro, típicamente, se rodea de seis electrones en compuestos como el trifluoruro de boro, BF3, o el tricloruro de boro, BCl3. La estructura de Lewis del trifluoruro de boro será:
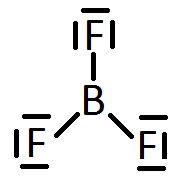
Por otra parte, en el caso de las excepciones por exceso, cuando los átomos que se enlazan son elementos no metálicos del tercer período (capa de valencia n=3), como el fósforo o el azufre, puede suceder que se rodeen de más de ocho electrones. Esto es debido al hecho de que se hallan disponibles (energéticamente accesibles) los orbitales 3d de estos átomos, y por ello pueden albergar más de 8 electrones en su capa de valencia. Así, el fósforo puede formar hasta 5 enlaces covalentes, como ocurre en el pentacloruro de fósforo, PCl5. La estructura de Lewis del pentacloruro de fósforo es:
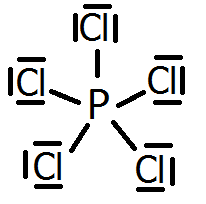
Y el azufre puede formar hasta 6 enlaces covalentes, como ocurre en el hexafluoruro de azufre, SF6. La estructura de Lewis del hexafluoruro de azufre es:
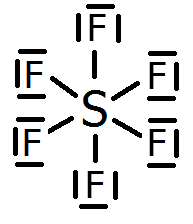
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Estructuras de Lewis.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Excellent!
dg, 13 Años Antes
😀 ¡Gracias!
Quimitube, 13 Años Antes
Es difícil poner atención a la química teniendo a una maestra tan hermosa, jeje 😀
Me sirvió de mucho tu explicación. Gracias.!
Saludos desde México.! 😀
Keviin Cruz, 11 Años Antes
De nada, muchas gracias a ti por tu comentario 🙂
QuimiTube, 11 Años Antes
La molécula de trifluoruro de boro tiene una estructura que no
es piramidal,es triangular plana.
Tres pares electronicos en torno al átomo central,nº estérico=3,
corresponde a ordenación Triangular plana(RPENV)..
SANTIAGO MARIÑO, 12 Años Antes
Hola Santiago, tiene razón, sé que es trigonal plana (si no supiese eso, mal vamos… ¿no?), sólo me he confundido al decirlo, cosas del «directo» 🙂 Imagino que todos los profesores se equivocan alguna vez durante el transcurso de una clase. Por este motivo agregué la rectificación como anotación durante el desarrollo del vídeo, tal vez las tenga desactivadas.
Además se puede ver correctamente en el vídeo correspondiente a la repulsión de pares electrónicos:
http://www.quimitube.com/videos/modelo-de-repulsion-de-los-pares-electronicos-de-la-capa-de-valencia-rpecv/
Un saludo.
QuimiTube, 12 Años Antes
Gracias.
Explican de manera sencilla lo que puede ser dificil.
M, 13 Años Antes
Gracias M, bienvenid@. Me alegro de que resulte sencillo, para ello trabajamos mucho el contenido del vídeo, esperamos ir mejorando cada vez más y puliendo fallos 🙂 Un saludo enorme.
QuimiTube, 13 Años Antes
Enhorabuena tus explicaciones son fabulosas, solo quiero felicitarte y animarte a que sigas trabajando así, un saludo 🙂
Alberto, 13 Años Antes
Muchas gracias Alberto por tomarte un tiempo para comentar y darme ánimos, me hace mucha ilusión 😀 Espero que los vídeos te vayan muy bien para tu preparación y sobretodo para aprender química, que es muy bonita jeje.
Un saludo enorme,
Carmen
QuimiTube, 13 Años Antes
está muy bien el video, gracias
miriam, 13 Años Antes
Muchas gracias Miriam y bienvenida 😀
QuimiTube, 13 Años Antes
gracias !! pero me faltaria el amoniaco!! no lo entiendo!! xD
matias amarillo, 13 Años Antes
¡Hola! ¿Te refieres a que te faltaría la estructura de Lewis del amoniaco? ¿O su geometría en general? Bueno, te paso estos vídeos donde encontrarás todo lo referente al amoniaco y su geometría, a partir de dos teorías, por una parte, el modelo de repulsión de pares electrónicos (si miras en el pie de vídeo verás la estructura de Lewis del NH3) y, por otra, la teoría de hibridación de orbitales atómicos. Un saludo.
http://www.quimitube.com/videos/modelo-de-repulsion-de-los-pares-electronicos-de-la-capa-de-valencia-rpecv/
http://www.quimitube.com/videos/hibridacion-sp3-de-la-molecula-de-amoniaco/
QuimiTube, 13 Años Antes
El trifluoruro de boro no tendría una estructura molecular triangular plana?
LV, 12 Años Antes
¡Hola! En efecto, el trifluoruro de boro tiene geometría trigonal plana, aunque en este vídeo aún no hemos hablado de geometría pero sí más adelante, por ejemplo en éste:
http://www.quimitube.com/videos/modelo-de-repulsion-de-los-pares-electronicos-de-la-capa-de-valencia-rpecv/
Espero que te sirva. Un saludo.
QuimiTube, 12 Años Antes
Me ha gustado mucho vuestra página! Buenísimo trabajo! 🙂
LV, 12 Años Antes
Mil gracias LV, a ver si podemos añadir nuevos contenidos cuanto antes 🙂
Quimitube, 12 Años Antes
Buenas, increíbles todos lo vídeos. De momento creo que voy a poder a optar a medicina gracias a ti, dado que no entiendo nada a mi profesora, se podría decir que eres algo así como mi salvación jajaja. Muchas gracias por estos vídeos fantásticos.
Lorena, 12 Años Antes
Hola Lorena, bienvenida y muchísimas gracias 🙂 Eso espero, que puedas optar a medicina, a ver si hay suerte (y mucho trabajo, ¡claro!) y sacas de 9 para arriba en Selectividad, me haría mucha ilusión saber que he ayudado a ello. Un saludo enorme.
QuimiTube, 12 Años Antes
Que tal, me comunico desde México, sólo tengo una simple pregunta que me gustaría saber si se puede realizar o tener.
Es posible con algún elemento químico tener un enlace de 5 carbonos, para tener un Penta PoliCarbonato _ _ _ _ _ ?
espero me puedas ayudar :p gracias y felicidades por tu sitio 😀
Eduardo Segura Hernández, 12 Años Antes
Hola Eduardo, bienvenido 🙂 Tal vez te serviría el fósforo que forma compuestos estables con valencia 5.
QuimiTube, 12 Años Antes
Hola soy nuevo en este sitio y estoy viendo todos sus vídeos, me han parecido excelentes. Estoy estudiando el primer año de universidad y me han servido demasiado. Gracias.
Rata bibliotecaria, 12 Años Antes
Me alegro mucho de que te sirvan y espero continuar ayudándote. Un saludo grande.
QuimiTube, 12 Años Antes
Hola, quería saber cómo puede ser la estructura del óxido de fosforo (V) o pentóxido de difosforo y la del Óxido de hierro (III), me estoy confundiendo mucho. Desde ya, muchas gracias y muy bueno el sitio.
Un saludo,
Federico.
Federico, 12 Años Antes
¡Hola Federico! La estructura del P2O5 es muy complicada, pero en wikipedia mismo puedes verla para hacerte mejor a la idea ya que no la puedo describir: http://es.wikipedia.org/wiki/%C3%93xido_de_f%C3%B3sforo_(V). En cambio, la del óxido de hierro (III) corresponde a la estructura de un compuesto iónico, formado por aniones O(2-) y cationes Fe(3+) dispuestos de dos formas distintas, o con el llamado sistema trigonal (como el corindón, Al2O3) o el sistema cúbico.
QuimiTube, 12 Años Antes
Buenas.! muy buena su explicacion Gracias!, pero lo que no logro entender porque el PCl5 , el fosforo queda con 10 e-? es por la hibridacion ? . Saludos
Micaela, 12 Años Antes
¡Hola! Es porque el fósforo tiene orbitales d accesibles, de hecho la hibridación en este caso es sp3d, es decir, se hibridan 5 orbitales atómicos para dar 5 orbitales híbridos y tiene 10 electrones a su alrededor (2 en cada orbital híbrido). Un saludo.
QuimiTube, 12 Años Antes
Gracia!!! El Aluminio tambien puede expandir su octeto?
Belen, 12 Años Antes
¡Hola Belén! En principio podría por estar en el tercer período y disponer de orbitales d, pero no lo hace en ningún compuesto (al menos que ahora mismo recuerde). De hecho el aluminio raramente forma compuestos de carácter covalente, dado su carácter metálico forma compuestos iónicos en su mayoría (salvo excepciones, como por ejemplo el Al(CH3)3).
QuimiTube, 12 Años Antes
Gx, estaba revisando un éster fosfórico y no recordaba porqué ocurría eso. Son geniales y sigan así impartiendo conocimiento.
Saludos
Seba
Sebastian, 12 Años Antes
Muchísimas gracias Seba, me alegro de que te sirvan 🙂 Un saludo grande
QuimiTube, 12 Años Antes
¿O sea que el trifluororo de boro no tiene ningun tipo de enlace covalente ( polar, apolar, coordinado)?
Zaida, 12 Años Antes
Hola Zaida, bienvenida. No debemos confundir ambos conceptos. El trifluoruro de boro sí presenta enlace covalente, entre el boro y cada átomo de flúor. Además será polar porque los dos átomos tienen diferente electronegatividad (el flúor es muy electronegativo, sus enlaces siempre suelen estar polarizados). Lo que ocurre es que el boro no tiene en torno a él 8 electrones sino 6, pero sigue formando 3 enlaces covalentes polares.
QuimiTube, 12 Años Antes
Muchas gracias por estos fantásticos videos. Los llevo viendo unos días y es impresionante lo bien explicado que está y lo bien que se adapta a mi temario en la universidad de Valladolid. Lo he comentado en clase y ahora casi todos los vemos porque es una gran ventaja poder repetir el video y copiar los conceptos clave.
Además al ver químicas tan guapas nos preguntamos si no nos hemos equivocado de carrera. Pero en fin, seguiremos con la ingeniería y gracias a estos videos creo que tenemos una grandísima ayuda a la hora de afrontar la asignatura.
Mis felicitaciones por ello y las de mis compañeros y nuestro más sincero agradecimiento por el esfuerzo realizado de grabar y editar y explicar todo esto, que me imagino que tiene su trabajo detrás.
Un saludo y hasta otra.
Oscar, 12 Años Antes
Hola Óscar, agradezco mucho tu comentario, me ha animado y me ha hecho sonreír 🙂 Me alegra mucho que se adapten tan bien a tu temario (aunque más adelante agregaremos contenidos adicionales para profundizar más en algunos puntos) y también te agradezco muchísimo que hayas recomendado los contenidos a tus compañeros, porque al final se trata de eso, del boca a boca.
Sí que es cierto que preparar los contenidos lleva un gran trabajo, pero estoy contenta de realizar el esfuerzo, está visto que merece la pena cuando ves que en efecto ayuda a muchas personas a prepararse una asignatura.
Un saludo para todos vosotros desde Mallorca y mucho ánimo con los estudios.
QuimiTube, 12 Años Antes
hola! queria saber algo, por que el trifluoruro de boro es un enlace covalente polar? si la diferencia de electronegatividad entre el boro y fluor supera los 1.7… osea es entre 2 o 1.9.. no deberia ser ionico?…… bueno lo q se yo es que si la diferencia de electronegatividad es:
1.7 ionico
estoy nose… muy dudoso. por fa vor aclarame esta duda.. te lo agradeceria de antemano
andres, 12 Años Antes
¡Hola! Es cierto que solemos decir que la diferencia de electronegatividad por encima de 1,7 se considera enlace iónico. Sin embargo, se ha determinado experimentalmente que el BF3 es una sustancia molecular, formada por moléculas independientes, y no por iones. Cuando estamos cerca de 1,7, en el límite, las sustancias no son 100% iónicas o covalentes, sino que tenemos un elevado porcentaje de ambas formas en el enlace. Un saludo.
QuimiTube, 12 Años Antes
gracias profe y espero que suban algunos videos de estequiometria porque usted explica perfectamente
PABLO, 12 Años Antes
Muchas gracias Pablo por tu comentario. Esperamos poder subirlos cuanto antes. Un saludo grande.
QuimiTube, 12 Años Antes
ademas de eficiente, hermosa !.
Muy buen video !
Ivan, 12 Años Antes
Muchas gracias Iván, bienvenido 🙂
QuimiTube, 12 Años Antes
Excelente material, muy claros los conceptos.
Saludos.
Milka, 11 Años Antes
¡Muchas gracias! Un saludo.
QuimiTube, 11 Años Antes
hola me puedes hacer el favor de darme mas ejemplos de exepciones con octetos expandidos…. gracias:D
jhon alejandro, 11 Años Antes
¡Hola! En general todos los átomos no metales del tercer período (y otros de más abajo) pueden albergar más de 8 electrones en torno a ellos por presentar orbitales d.
QuimiTube, 11 Años Antes
¡Guau!, es genial que existan personas tan lindas e inteligentes a la ves. ^^
Gracias por tus vídeos, me han ayudado mucho, sigue así. =)
Alvaro, 11 Años Antes
Muchas gracias Álvaro, espero que te sigan ayudando los contenidos. Un saludo grande.
QuimiTube, 11 Años Antes
hola, me encantan las explicaciones, son sencillas y claros los ejemplos…
tengo una duda sobre los orbitales s en los que se encuentran los electrones apareados libres, en el caso del fósforo en PCl5, estos orbitales hibridan???
agradecería mucho tu respuesta… Gracias 😀 y continúa con esto
sandra henriquez, 11 Años Antes
¡Hola Sandra! Perdona, no me ha sido posible responder a los comentarios antes… Tal vez ya no necesites la respuesta, pero aquí está, más vale tarde que nunca 🙂 Sí, en el PCl5 puedes considerar una hibridación sp3d para el fósforo, aunque realmente no se va más allá de sp3 en Selectividad o primer curso universitario. Un saludo.
QuimiTube, 11 Años Antes
¿Solo son estas las excepciones que debemos conocer o simplemente son las más frecuentes? Muchas gracias y enhorabuena
Cris, 11 Años Antes
¡Hola! Podrías encontrar algunas otras, pero realmente para Selectividad o primer curso universitario yo creo que son suficientes. En general, todos los átomos del tercer período cuando actúan como átomo central pueden expandir el octeto. Un saludo.
QuimiTube, 11 Años Antes
Oh! creo que me he enamorado, muy buena pagina esan didacticos los videos.
Percy, 11 Años Antes
Muchas gracias Percy, me alegra que te sirvan los vídeos. Bienvenido.
QuimiTube, 11 Años Antes
Buenas! Una pregunta, pueden formar enlace covalente combinado las moléculas de BF3 y BCl3. Y en caso afirmativo, porque?
Muchas gracias
Sofía, 11 Años Antes
¡Hola Sofía! No entiendo bien la pregunta, sería combinar ambas moléculas? A lo mejor hace referencia a los diboranos: http://es.wikipedia.org/wiki/Diborano. Un saludo.
QuimiTube, 11 Años Antes
Muchas gracias!! Lo he entendido mucho mejor que en clase, y eso que puse toda mi atención en la explicación. Por fin encuentro una página web que me guíe un poco con FyQ.
Mr. Rain, 11 Años Antes
¡Hola! Me alegra mucho que te haya servido y que pongas toda tu atención en clase, así es como lograrás sacar una buena nota 🙂 Mucha suerte con tus estudios. Un saludo.
QuimiTube, 10 Años Antes
Soy maestro de matemáticas pero tengo necesidad de impartir unas horas de química muy buenas explicaciones y claro la maestra muy guapa. Saludos desde Sabinas Hidalgo Nuevo León México.
JUAN ENRIQUE GARCÍA GUZMAN, 10 Años Antes
Hola Juan Enrique, muchas gracias por tu comentario y suerte con esas clases de química. Un saludo.
QuimiTube, 10 Años Antes
hola profe me gustaria saber por que razon qieda raro el BF3 si es porque es asi y punto o si tiene una razon?
gracias
manuela, 10 Años Antes
Hola Manuela:
Se ha determinado experimentalmente que la molécula de BF3 tiene esa estructura, además que con el número de electrones que presenta no puede ser de otro modo. Las razones por las que un compuesto es como es siempre son de estabilidad, si «se encuentra a gusto» de este modo es porque al formarse su energía libre de Gibbs es negativa (un parámetro termodinámico) y hace que el producto final, BF3, sea estable.
QuimiTube, 10 Años Antes
hola una consulta .por que el pentaóxido de diyodo,el yodo en la estructura de lewis tiene 5 electrones ????
alejandra, 10 Años Antes
Hola Alejandra, he visto la estructura que comentas, realmente no me parece correcta porque faltarían electrones, ya que tenemos que tener 7 electrones por cada yodo y 6 por cada oxígeno, de modo que en total serían 5×6+2+7 = 44 electrones, 22 pares.
QuimiTube, 10 Años Antes
Hola,buen video …Tendria una consultita …¿de que se tratan
la geometria molecular y la geometria electronica? Desde ya muchas gracias
Nacho, 10 Años Antes
¡Hola! Te sugiero ver estos vídeos para comprender mejor:
http://www.quimitube.com/videos/enlace-covalente-polaridad-de-enlace-y-polaridad-molecular
Y este:
http://www.quimitube.com/videos/modelo-de-repulsion-de-los-pares-electronicos-de-la-capa-de-valencia-rpecv
En este último verás que una cosa es la disposición de los pares electrónicos de valencia (geometría electrónica) y otra cosa distinta la geometría molecular final (si la molécula tiene pares electrónicos libres).
QuimiTube, 10 Años Antes
No se si preguntar una duda..
O pedirte tu número! <3
Eres muy bonita.
David ruiz, 9 Años Antes
Muchas gracias David, espero que no preguntes dudas porque no tengas ninguna 🙂 Un saludo
QuimiTube, 9 Años Antes
Muy buena información, me salvó el día!
Adilson, 9 Años Antes
Me alegro mucho, un saludo.
QuimiTube, 9 Años Antes
me pueden explicar COVALENTE (polar-
apolar)
yeki, 5 Años Antes
¡Hola! Te sugiero ver todos nuestros vídeos de teoría de enlace químico en orden, ahí verás las explicaciones más detalladas. También tienes explicaciones teóricas a pie de vídeo. Un saludo.
QuimiTube, 5 Años Antes