Contenido del Vídeo
El enlace iónico se da entre elementos metálicos (electropositivos) y elementos no metálicos (electronegativos). Por ejemplo, las combinaciones de metales alcalinos y alcalinotérreos (los dos primeros grupos de la tabla periódica) y los halógenos (F, Cl, Br…) forman compuestos típicamente iónicos. Como su propio nombre indica, un compuesto iónico presenta un enlace que se da por atracción electrostática entre iones: entre cationes procedentes del metal, de carga positiva, y aniones procedentes del no metal, de carga negativa.
¿Cómo es posible que estos compuestos formen iones? Bueno, podríamos decir de forma genérica que los metales tienen cierta tendencia a ceder electrones y los no metales tienen cierta tendencia a captarlos. Aunque, como explicaremos en el vídeo el proceso es endotérmico (hay que aportar energía para formar los iones), éste aumento energético se verá compensado por la posterior formación de una red cristalina.
Consideremos el cloruro sódico, NaCl, la sal común (sal de cocina). El sodio es un metal alcalino que tiene, por tanto, un electrón en la capa de valencia. El cloro es un halógeno que tiene 7 electrones en la capa de valencia. Así, sus respectivas configuraciones electrónicas son:
Na (Z = 11): 1s2 2s2 2p6 3s1
Cl (Z = 17): 1s2 2s2 2p6 3s2 3p5
Como vemos, si el sodio pierde un electrón, quedará como catión sodio, Na+, y adquirirá la configuración electrónica del gas noble anterior, el neón. Por su parte, el cloro, muy electronegativo, tiene 7 electrones en la última capa. No tiene sentido pensar que pierda 7 electrones, sino que capta uno (el electrón que cede el sodio) para dar el anión cloruro y quedar, también, con una configuración electrónica de gas noble, en este caso la del argón. Recordemos que la configuración electrónica de un gas noble, con 8 electrones en la última capa, es muy estable, por lo que el Na+ y el Cl- también son muy estable. Tendremos, por tanto:
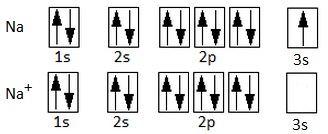
Configuración electrónica del sodio y del catión sodio (ha perdido el electrón 3s).
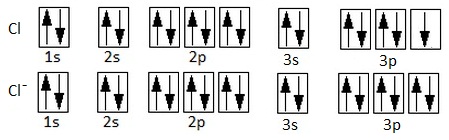
Configuración electrónica del cloro y del anión cloruro (ha ganado un electrón en un orbital 3p).
Al número de electrones que un metal cede o un no metal capta en la formación de un compuesto iónico se le llama valencia iónica o electrovalencia.
Por tanto, en la formación de un compuesto iónico el metal cede electrones, quedando como un catión, y el no metal capta electrones, quedando como un anión. Los cationes y aniones formados se mantienen después unidos entre sí por atracción electrostática, formando una red cristalina altamente ordenada.
En realidad, el paso de Na a Na+ y de Cl a Cl- es un proceso globalmente desfavorable (endotérmico) según vemos en los siguientes valores de energía:
![]()
![]()
A pesar de que hemos dicho que los metales tienen tendencia a ceder electrones y los no metales a captarlos, se puede observar en los datos previos que para obtener un mol de Na+ y un mol de Cl- hay que aportar una energía global de 146 kJ /mol (495 – 349). Este aporte energético inicial se ve compensado por la posterior formación de un compuesto en forma de red, que constituye el compuesto iónico. En la formación del compuesto iónico se desprende una cantidad muy grande de energía, que recibe el nombre de energía reticular.
Así, la energía reticular, representada como Ur , se define como la energía desprendida cuando se forma un mol de compuesto iónico a partir de los iones en estado gaseoso:
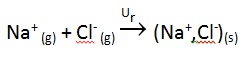
¿Qué significa que sea una red cristalina? Significa que es una estructura sólida altamente ordenada, formada por cationes y aniones siempre en la misma proporción (la proporción estequiométrica para mantener la neutralidad eléctrica) y en las mismas posiciones fijas. Las posiciones fijas establecidas para los cationes y los aniones dependen del tipo de red iónica que tengamos. No todas las redes iónicas son iguales, tenemos distintos tipos de estructuras.
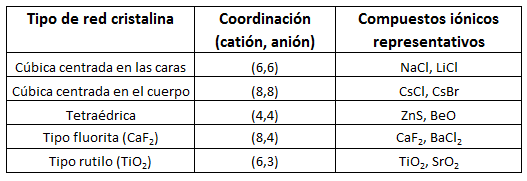
Como cada ión genera a su alrededor un campo eléctrico que es igual en las tres direcciones del espacio, cada uno de ellos tiende a rodearse de un número fijo de iones de signo contrario. Este número recibe el nombre de índice de coordinación o número de coordinación. El índice de coordinación varía según el tipo de red. Por ejemplo, en el caso del NaCl, cada sodio se rodea de 6 cloruros y cada cloruro se rodea de 6 sodios. El número de coordinación para ambos iones es 6, es una estructura (6,6), que recibe el nombre de estructura cúbida centrada en las caras:
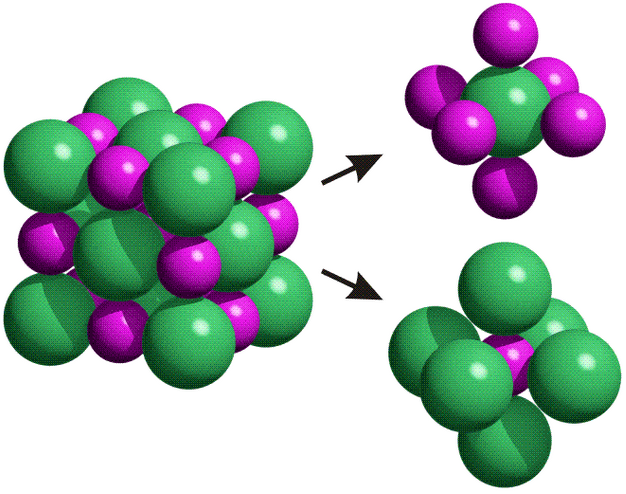
Estructura cristalina del cloruro sódico, NaCl. Los cloruros aparecen en verde y los sodios en morado. Se puede observar que cada sodio se rodea de 6 cloruros (índice de coordinación) porque no hay espacio para más.
El índice de coordinación del catión y del anión en una red cristalina depende, esencialmente, de dos factores:
- Tamaño de los iones. El valor del radio de los iones marcará la distancia a la que se pueden situar por una simple cuestión de espacio. Por ejemplo, el sodio catiónico, Na+, tiene un radio de 0,95A, y el cloruro de 1,81A. Esta diferencia de tamaños hace que cada sodio sólo se pueda rodear de 6 cloruros. En el caso de redes cuyos tamaños iónicos son más semejantes, como por ejemplo el cloruro de cesio, CsCl (Cs+ 1,70A y Cl- 1,81A), los iones se pueden rodear de un mayor número de iones de carga opuesta, y esta red iónica presenta coordinación (8,8), que es la llamada cúbica centrada en el cuerpo. Cada ión cesio se rodea de 8 cloruros, y cada cloruro de 8 cesios.
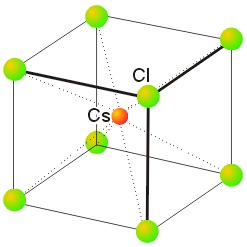
- Carga de los iones. Como el cristal es eléctricamente neutro, si los iones tienen carga distinta esto condicionará la estequiometría y, por tanto, la estructura y el índice de coordinación. Por ejemplo, en el caso de la fluorita, que es el fluoruro de calcio, CaF2, vemos que como la valencia iónica del calcio es +2, porque es un metal alcalinotérreo que puede perder dos electrones de la última capa, y el F tiene una valencia iónica de -1, habrá 2 aniones F- por cada catión Ca2+. Esto hace que, en este compuesto, el calcio se rodee de 8 fluoruros y el fluoruro de 4 calcios, presentando una coordinación (8,4). A este tipo de estructura, por analogía con la fluorita, se la denomina estructura tipo fluorita.
A continuación hallamos una tabla con algunos tipos de estructuras cristalinas iónicas, con sus correspondientes números de coordinación y algunos compuestos representativos.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Muchas gracias guapa!! 🙂 🙂
dg, 11 Años Antes
¡De nada! Gracias a ti por comentar y por seguirnos 🙂
Quimitube, 11 Años Antes
Hola!
eh…. el indice de coordinacion como lo hallo? o es que me lo tienen que dar? ….uff
Muchas gracias!
didi, 11 Años Antes
Bueno, el índice de coordinación no es algo que te suelan pedir (si estás en bachillerato, al menos), a no ser que sea el de algunos compuestos conocidos, de los cuales lo sepas por el tipo de estructura que forman (como los que están en la tabla). Pero dudo mucho que te pongan un dibujo de una estructura y te pregunten el índice de coordinación, requiere bastante visión espacial y un poco de práctica…
QuimiTube, 11 Años Antes
Me he visto absolutamente todos tus videos y gracias a ti tengo alguna posibildad de aprobar mi examen de Qumica !
Muchisimas gracias de crazón, eresde grandisima ayuda !
Sandra, 11 Años Antes
Hola Sandra, bienvenida 🙂 Me alegro mucho de que te sirvan de ayuda y espero que no sólo tengas alguna posibilidad, sino que saques mejor nota de la que esperas 😀 Gracias por tomarte parte de tu tiempo para comentar, me anima muchísimo para continuar haciendo esto. Un saludo enorme.
QuimiTube, 11 Años Antes
gracias me ayudo mucho y aprendí algo mas..Es el primer vídeo que veo y me sirve de mucho y gracias a ti tengo alguna posibilidad de saber esa técnica del enlace de ionico..
Muchísimas gracias de corazón, eres de grandisima ayuda !
alma, 11 Años Antes
Hola Alma, bienvenida y muchas gracias por comentar 🙂 Me alegro de que te sirviera este vídeo, espero que también te sirvan los demás de mucha ayuda y tengas suerte en tus estudios. Un saludo grande.
QuimiTube, 11 Años Antes
hola,me podria esplicar por que un cloruro de sodio es crista visible y el cloruro de fierro no???
Ed, 11 Años Antes
¡Hola! No entiendo bien a qué te refieres con «visible».
QuimiTube, 11 Años Antes
esta muy muy bien expresado y bien dicho adoro esta pagina
juan carlos gomez, 10 Años Antes
mee gusttariia saber cuales son las tipos de redes de iones
johana, 10 Años Antes
Hola Johana, aquí en este mismo vídeo tienes los tipos principales en la explicación escrita. Un saludo.
QuimiTube, 10 Años Antes
El radio atomico aumenta de derecha a izquierda en la tabla periodica, entonces como es que el Cl tiene radio mas grande que el Na?
Sachet, 10 Años Antes
¡Hola! Lo que ocurre es que son iones. El cloro neutro es más pequeño que el sodio neutro, pero aquí tienes cloruro, Cl-, con un electrón adicional, y sodio catiónico, Na+, con un electrón menos. Por eso en este caso el Cl- es más grande que el Na+. Los aniones suelen expandir mucho el radio con respecto al átomo neutro, mientras que los cationes suelen contraerlo bastante.
Quimitube, 10 Años Antes
verdad que si! ahora me cai de la mata hihhihi pues tienes toda la reazon! ahora me recuedo que los cationes reducen en radio y los aniones lo contrario!
Gracias!! Mil gracias!
Sachet, 10 Años Antes
yo todavia no entiendo como hallar el numero de coordinacion! poque el Na se rodea de 6 iones! si solo puede juntarse con un Cl esto me tiene confundida?
Sachet, 10 Años Antes
Para que el compuesto sea eléctricamente neutro tiene que haber 1 Na+ para cada Cl-, pero es una red muy grande y por eso el sodio se rodea de 6 Cl-, porque la red se va ordenando de esta forma. Eso no significa que para 1 Na+ haya 6 Cl-, porque tienes que tener en cuenta que a su vez cada uno de esos Cl- se rodea de 6 Na+, y así sucesivamente. El resultado final es que efectivamente la proporción es 1:1, un Na+ por cada Cl-.
Quimitube, 10 Años Antes
Hola! Muchas gracias! eres muy amable en responder a todas nuestra dudas. lamentablemente todavia no entiendo bien esto. deja ver si con los ejercicios me se me abren las entendederas.
Dentro de un rato volvere a ver video otra vez …..
Gracias linda! 🙂
Sachet, 10 Años Antes
Muchísimas gracias por lo que haces, en tiempos de crisis no todos podemos permitirnos un profesor particular y ésto es una bendición, si lo hubiese descubierto antes no me habría quedado química. GRACIAS, GRACIAS Y GRACIAS.
the2clocksgirl, 10 Años Antes
¡Muchas gracias a ti! Me alegra mucho saber que os sirve, sobretodo por esto que dices, no todo el mundo puede ir a clases particulares por muchas circunstancias y saber que esto es una ayuda me alegra mucho. Un abrazo.
QuimiTube, 10 Años Antes
Muchas gracias me ha servido mucho este articulo E aprendido mas y me a ayudado mucho con mi trabajo 😉 se nota a leguas q eres toda una esperar en el tema 😉
darwin, 10 Años Antes
Muchas gracias Darwin, me alegra que te sirva 🙂
QuimiTube, 10 Años Antes
el indice de coordinacion como se encuentra??
Jesus, 10 Años Antes
Hola Jesús, para ello debes contar cuántos iones de signo contrario rodean directamente al ion que consideres. Es decir, si consideras el catión, cuántos aniones lo rodean y viceversa.
QuimiTube, 10 Años Antes
Hola, me quito el sombrero. Enhorabuena por este site y todo el trabajo que está realizando, tiene un don que muchos profes quisieran, no todo el mundo sabe enseñar o quizás exista falta vocación…
Me está ayudando a recordar conocimientos que estudié hace 20 años para dar clases de apoyo a mi hijo mayor…
Un saludo.
Victor.
victor, 9 Años Antes
¡Hola Víctor! Muchísimas gracias por tu comentario, me ha hecho muchísima ilusión. Me encanta la enseñanza y poder transmitirlo es muy enriquecedor. Mucha suerte con esas clases de apoyo, espero que disfrutéis los dos de la química aunque sea un poco… Un saludo grande y bienvenido.
QuimiTube, 9 Años Antes
Hola buenas tardes, sigo sin entender donde viene el (6,6) en el indice de coordinacion.
Un saludo,
Ornela
ornela, 8 Años Antes
Hola Ornela, fíjate en la estructura, coge un ion y luego cuenta cuántos iones del signo contrario lo rodean… Verás que son 6. Lo mismo ocurre para cationes y para aniones, por eso decimos que el índice de coordinación es (6,6). También te puede venir bien construir un modelo molecular físico, para poder tocarlo, rotarlo… Un saludo.
QuimiTube, 7 Años Antes
Hola, me gustaria saber como sabes cual es su numero de coordinación o es un dato que te lo tienen que dar. Muchísimas gracias por tu ayuda!!!
Andrea, 8 Años Antes
¡Hola! Te lo tienen que dar porque si no sabes previamente el tipo de red cristalina que se formará es imposible saberlo.
QuimiTube, 3 Años Antes
!Hola!
Será que me podrias ayudar la siguiente cuestión:
«El tipo de red de un compuesto ionico depende de la carga de los iones y de la relacion de los radios del cation y anion»
Es verdad o falsa y porqué!!
Qué crees que es?
Lúcia, 8 Años Antes
¡Hola! Esto es cierto porque la relación de radios hace que un ion se pueda rodear de más o de menos iones de signo contrario. Asimismo, la carga de los iones te indicará la proporción de estos en el cristal y por tanto, necesariamente ha de influir también en la disposición de los mismos en la red cristalina.
QuimiTube, 3 Años Antes
hola muchas gracias por tus videos me ha ayudado bastante, pero tengo una duda en el minuto 4:49 dijiste los cationes y aniones se atraen electroestaticamente formando una red covalente, no sera que forman una red cristalina?
Yonathan, 7 Años Antes
¡Hola! Sí disculpa, por supuesto es una «red cristalina», no una «red covalente», disculpa el lapsus. Recuerda que las redes covalentes son de naturaleza muy distintas a estas, como por ejemplo el diamante y el grafito. Un saludo y gracias por comentarlo.
QuimiTube, 7 Años Antes
Esto no vale para nada es una porquería bi todos tus vídeos y no valen paranada suspendí el examen de química no se como pudiste hacer esta página
paquito, 7 Años Antes
Hola, lamento que no te sirvieran, pero como comprenderás mi material no es una varita mágica para aprobar, del mismo modo que no aprobarás por tener un libro estupendo o muy caro. Si no aprobaste sin duda te faltó estudio, siempre es ese el motivo de los suspensos, aunque prefieras volcar tu frustración en mí para descargarla de ti mismo. Un saludo.
QuimiTube, 7 Años Antes
gracias profe, por el excelente material que tiene en la red, es de gran ayuda y también es una manera de empezar a ver la química sin miedos, y de manera agradable, una consulta Qué relación hay entre la cantidad de partículas que hay en la celda unidad, (por ejemplo del cloruro de sodio) y la fórmula yo creo que es la proporción de cationes y aniones es 1-1 y en la celda unidad al haber 4 cationes y 4 aniones es también 1-1, me lo aclaras , gracias
yanett, 7 Años Antes
Hola Yanett, la proporción que haya en la celda unidad y en la fórmula debe ser la misma siempre, ya que es la proporción de todo el cristal. Ahora bien, la celda unidad tiene más de un anión y de un catión porque es una estructura, necesitamos saber cómo están colocados los iones y no solo en qué proporción. La celda unidad es la porción más simple del compuesto que nos da esta información: si la repetimos en las 3 dimensiones del espacio una y otra vez, tenemos la estructura del cristal completo. Un saludo.
QuimiTube, 7 Años Antes
Me ha encantado vuestro post y me ha sabido a poco pero ya sabeis lo que dice el dicho «si lo bueno es breve es dos veces bueno». Me gustara volver a leeros de nuevo.
Saludos
centralita virtual, 5 Años Antes