Contenido del Vídeo
Hemos predicho a partir del Modelo de repulsión de pares electrónicos de la capa de valencia, RPECV, que la molécula de cloruro de berilio es lineal, es decir, los dos enlaces berilio-cloro forman un ángulo de 180º.
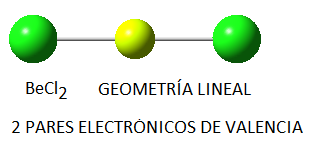
Experimentalmente se sabe, en efecto, que su geometría es lineal, así como que los dos enlaces berilio-cloro son idénticos. Sin embargo, si consideramos la configuración electrónica del berilio, que tiene un número atómo 4 (Z = 4):
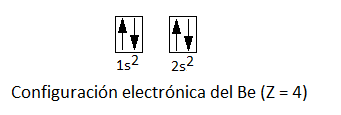
Vemos que no tiene electrones desapareados, pues su capa de valencia, n=2, está formada por un orbital 2s que está completo. Así pues, cabe preguntarse: ¿cómo es posible que el berilio forme dos enlaces covalentes si, según el Modelo del enlace de valencia (MEV), los orbitales que forman enlace covalente deben estar semiocupados? Para justificar esto se acepta que un electrón del orbital 2s promociona a un orbital 2p vacío, que es relativamente accesible. Este hecho se justifica porque, aunque hay que aportar energía para que se produzca esta promoción, este aporte energético es compensado por la formación posterior de dos enlaces covalentes, en cuya formación se desprende mayor cantidad de energía.
Por tanto, el berilo pasa de un estado fundamental a un estado excitado:
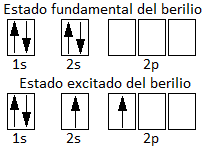
Esto explicaría que se formen dos enlaces covalentes, pero no que sean idénticos. Si los orbitales atómicos que se enlazan ahora son el 2s y el 2p con los orbitales p del cloro, estos enlaces serán distintos. Por ello, Pauling propuso el concepto de Hibridación de orbitales atómicos. El orbital 2s y el orbital 2p del berilio se hibridan (se mezclan) para dar dos orbitales iguales que llamamos híbridos sp. Los 2 híbridos sp son equivalentes en forma y energía, y tienen propiedades intermedias entre un orbital s y un orbital p (50% de contribución de cada uno de ellos). Una vez producida la hibridación, podemos escribir la configuración del berilio como:
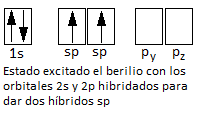
Una vez que se han hibridado los orbitales 2s y 2p para dar dos híbridos sp, estos se colocarán lo más separados posible para minimizar la repulsión entre ellos, es decir, 180º, disposición lineal (como se sabe experimentalmente que es el cloruro de berilio). Cada uno de estos híbridos tendrá ahora un electrón desapareado con e cual se podrá solapar con un orbital p del cloro. Este solapamiento es frontal (en el mismo eje del enlace) por lo que se trata de un enlace simple de tipo sigma (σ), fuerte por la elevada interpenetración. El diagrama para dicha molécula será:
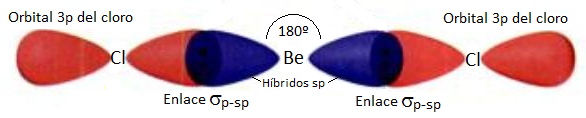
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente, Geometría molecular e hibridación y Modelo enlace de valencia.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola, antes de hacerte mi pregunta me gustaría felicitarte por la gran labor que estás realizando.
Bueno mi pregunta es: el cloruro de berilio es la unión de dos elementos muy diferentes en electronegativida. A priori podríamos pensar que el tipo de enlace sería iónico, tal como ocurre con el cloruro de sodio. Por qué el cloruro de berilio no es un compuesto ionico y si covalente ?. Lo que se me ocurre es que experimentalmente se haya comprobado que es covalente, pero que es lo qué hace que sea covalente y no iónico?
Saludos y muchas gracias
José Antonio, 12 Años Antes
Hola José Antonio, es una buena pregunta, de modo que estoy creando una entrada de blog que publicaré entre hoy y mañana para profundizar en este asunto.
QuimiTube, 12 Años Antes
Aquí lo tienes, una respuesta un poco más elaborada 🙂 Un saludo
http://www.quimitube.com/el-enlace-del-cloruro-de-berilio-es-covalente-o-ionico/
QuimiTube, 12 Años Antes
Ya he visto tu entrada del blog. Perfectamente entendido. Muchisimas gracias
José Antonio, 12 Años Antes
Porque el Berilio es una excepción y tiende a formar enlaces covalentes.
Juli, 8 Años Antes
Hola profe, no sé si te acuerdas de mi jajaj…. Necesito que me digas si estoy entendiendo bien este tema o no…. Mi profe de química me dio a entender una cosa que no me cuadra…¿En un átomo de hidrógeno podríamos encontrarnos orbitales p aunque no tengan que estar llenos de electrones? Es que me suena fatal…
Me intento explicar mejor, en el vídeo has puesto que para que se de el enlace, es necesario que antes haya una excitación de un electrón de 2s2 para ir a un orbital 2p, el berilio no tiene ningún orbital p en su configuración electrónica.
Lo que yo entiendo de aquí es que en el período 2 de la tabla periódica existen orbitales p aunque hay elementos que no los llenan como el berilio y a partir del período 3 ya hay orbitales D aunque haya elementos que no los llenen. ¿Lo estoy entendiendo bien o estoy diciendo cosas sin sentido?
Otra cosilla… No termino de ver porque es necesaria la hibridación de orbitales para llevar a cabo el enlace, quizás es porque la química está mal organizada en cuanto a temario y nos repiten tantísimas veces en secundaria y en primero de bachillerato «enlace covalente se da entre no metales y es una compartición de electrones» que ahora cuesta muchísimo abrir nuestras mentes para entender lo que realmente pasa xD.
Lo que yo entendí de aquí es que para que se de esa compartición de electrones es necesaria la hibridación porque un orbital p y un orbital s no son degenerados y si se enlazaran cada orbital con un cloro, (¿la energia de enlace?) seria distinta y se ha visto experimentalmente que no es así, que ambos enlaces tienen la misma (¿energia de enlace?) y que esto ocurre con todos los enlaces covalentes ¿Estoy entendiéndolo bien o se trata de otro motivo?
Por último, ¿de dónde capta la energía el berilio para pasar a un estado excitado? ¿es posible que haya condiciones desfavorables para la formación de este enlace y que, por tanto, no se forme?
PD. También te quería hacer unas preguntas que no van relacionadas con dudas del temario de química, ¿Grabarás vídeos con contenido universitario? Es que posiblemente haga química en la universidad, bueno me da muchísimo miedo, tengo que terminar de pensármelo. Mi miedo no es entender la química, de hecho la entiendo y la interiorizo bastante bien, mi problema es que no estoy haciendo física en bachillerato, sólo hice la física de primero de bachillerato en segundo me cambié y me han dicho que es necesario haberla dado tanto en primero como en segundo. A mi me gusta muchísimo la química, no me gustaría estudiar otra cosa en la universidad porque me acabaría amargando. ¿Qué me recomiendas?
Muchísimas gracias por los videos que haces! Me sirven muchísimo y son increíblemente perfectos! Graciasgracias y mil gracias!
Cristian, 11 Años Antes
¡Hola Cristian! Sí que me acuerdo de ti, claro 🙂
Bueno, podríamos decir que los orbitales no son más que estados energéticos de los electrones y que todos los átomos tienen todos los posibles orbitales, o al menos teóricamente. Lo que ocurre es que normalmente la diferencia de energía entre los orbitales del estado fundamental, como el 1s del hidrógeno, están tan lejos del siguiente orbital, en este caso el 2s, que no es muy normal encontrar un átomo de hidrógeno excitado con la configuración 2s1. Sin embargo, como te digo, teóricamente esos orbitales «están ahí» aunque vacíos (lo pongo entre comillas porque el orbital no es algo físico, no es una línea ni un volumen delimitado, solo el electrón girando).
La hibridación es necesaria para explicar, fundamentalmente, lo que has dicho, que ambos enlaces sean equivalentes, y también el ángulo de enlace. Si la molécula es lineal tienes que tener dos orbitales formando un ángulo de 180º, y esto es incongruente con que el berilio no sufra hibridación.
En cuanto al hecho de metal + no metal, tengo una entrada de blog que te vendrá como anillo al dedo:
http://www.quimitube.com/el-enlace-del-cloruro-de-berilio-es-covalente-o-ionico/
Por último, la captación de energía… Tienes que tener en cuenta que la formación posterior de dos enlaces Be-Cl hará que el proceso sea globalmente favorable. En química siempre tienes que mirar el proceso a nivel global, ya que será esto, el valor de DG global (energía libre) el que hará que sea termodinámicamente favorable o no, aunque un paso intermedio, como en este caso la excitación del berilio, no lo sea.
P.D. Si te gusta la química yo estudiaría química sin dudarlo. Por la física no te preocupes. Sí, hay física en primero y te habría convenido mucho darla en bachillerato, pero siempre puedes recurrir a otros métodos: libros, internet, academias o profesores particulares… No creo que una sola asignatura te pueda echar atrás a la hora de escoger unos estudios, sería un motivo demasiado pobre para no estudiar lo que te gusta. Esa es mi opinión 🙂
un abrazo.
QuimiTube, 11 Años Antes
Muchas gracias por tu opinión! De hecho, el otro día fui a las puertas abiertas de la facultad de química y ya nos explicaron que mayoritariamente la gente no hace física en el bachillerato (cosa que no tendría que ser así) pero me calmó bastante porque nos dijeron que los profesores estaban «acostumbrados» y ya me terminé de convencer 🙂
Cristian, 11 Años Antes
Hola Carmen! Me preguntaba dónde se encuentra el orbital s en el dibujo final que realizas pues en torno al Berilio dibujas un híbrido sp, otro híbrido sp y luego los dos cloros. ¿Tendría que estar en el centro del Be o me estoy confundiendo? GRACIAS POR TODO!!!!!! 😀
Ángela, 11 Años Antes
¡Hola! Si te refieres al 1s2, no hace falta que lo dibujes porque no es de la capa de valencia y no interviene en el enlace. Fíjate que para los cloros tampoco dibujamos los otros que no intervienen ni las capas o niveles electrónicos inferiores. Si te refieres al 2s2, digamos que ya no está, porque al haberse hibridado con un orbital p ambos se convierten en 2 híbridos. Un saludo y muchísimas gracias por tu comentario y por tu apoyo.
Quimitube, 11 Años Antes
Peque es becl2? Una sal binaria?
Marisol, 11 Años Antes
Hola Marisol, como vemos aquí el BeCl2 es más covalente que iónico, forma moléculas. Aquí tienes una explicación más profunda de este hecho:
http://www.quimitube.com/el-enlace-del-cloruro-de-berilio-es-covalente-o-ionico
QuimiTube, 11 Años Antes
OLA TODO ES MUY ENTENDIBLE , PERO NECESITO MAS EJEMPLOS MINIMO 10 DE CADA HIBRIDACION (SP, SP2, SP3) HE BUSCADO EN INTERNET PERO ENCUENTRO LOS MISMOS QUE USTED HA HECHO PODRIA AYUDARME!!
ITA, 10 Años Antes
Se me ocurre que vayas compuesto por compuesto, en muchos de ellos en wikipedia te indica la hibridación del átomo central…
Por otra parte ten en cuenta que un carbono con 1 enlace triple y uno simple tiene hibridación sp. Cualquier compuesto orgánico con un triple enlace tendrá una hibridación sp al menos.
Lo mismo para un carbono con un doble y dos simples, siempre será sp2.
Y cualquier carbono con los 4 simples es sp3.
QuimiTube, 10 Años Antes
Me podría ayudar con una tarea llamada combinaciones de hibridaciones ?
Karen Viridiana Álvarez Cruz, 10 Años Antes
¡Hola! ¿En qué consiste la tarea?
QuimiTube, 10 Años Antes
Me puedes decir ejemplos de la vida cotidiana de las geometrías moleculares lineal (180°), angular (120°), trigonal plana (120°), tetraedrica (109°), piramidal (109°) y angular (109°) por favor es urgente
Javiera, 10 Años Antes
es genial esto
yhonm, 10 Años Antes
hola… mi profesora me pidio que realice la estructura del BeCl2 y el CaCl2 ambos en estado solido… quisiera saber si es la misma estructura que utilizaste. gracias
sergop, 10 Años Antes
¡Hola! No, el cloruro de calcio es un compuesto iónico que forma una red cristalina.
QuimiTube, 5 Años Antes
Hola que tal, tengo una duda para hacer la hibridacion del CaCl2 la configuracion del calcio termina en 4s2 que son los electrones que puede compartir, mi pregunta es un electron se promueve al orbital 4p? Y la hibridacion es sp? Y ahora si se puede enlazar con los orbitales p del cloro? Y se formaria un enlace tipo sigma sp-p? Muchas gracias
Gema, 7 Años Antes
¡Hola! En el caso del CaCl2 el compuesto es iónico, no lo planteamos como un enlace covalente.
QuimiTube, 5 Años Antes
Hola me podria ayudar con una duda?
Gema, 7 Años Antes