Contenido del Vídeo
Según datos experimentales, se sabe que la molécula de eteno (o etileno) es totalmente plana y que sus enlaces forman ángulos de 120º. Además, la molécula presenta un enlace doble carbono-carbono, siendo el ejemplo más sencillo de los hidrocarburos lineales conocidos como alquenos. Su estructura de Lewis se puede representar como:
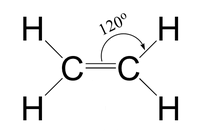
Como vimos para el caso de la molécula de oxígeno en la explicación del Modelo del Enlace de Valencia, un doble enlace se formará por dos tipos de enlaces: por una parte, un enlace de tipo sigma, σ, que corresponde a un solapamiento frontal de dos orbitales atómicos que pueden ser iguales o distintos (orbitales s, p, híbridos…); por otra parte, un enlace de tipo pi, π, que corresponde al solapamiento lateral de 2 orbitales atómicos de tipo p (siempre de tipo p, sin hibridar ni modificar).
Esto implica que para que un átomo de carbono pueda formar un doble enlace con otro átomo de carbono, tiene que presentar, necesariamente, un orbital p puro, sin hibridar. Es por este motivo que la hibridación de un carbono con enlace doble no es sp3, como en el caso del carbono con enlace simple, sino hibridación sp2 (se hibrida el orbital 2s y 2 de los orbitales p, y el tercer orbital p queda sin hibridar).
Consideremos primeramente la configuración electrónica del carbono:
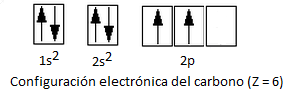
Como vemos y ya hemos estudiado para el caso de la hibridación sp3 del metano y el etano, esta configuración electrónica sólo presenta 2 electrones desapareados, motivo por el cual sólo permitiría la formación de 2 enlaces covalentes. No obstante, el carbono forma 4 enlaces covalentes. Por ello, aceptamos que un electrón del orbital 2s promociona la orbital 2p vacío, pasando por tanto a un estado excitado con 4 electrones desapareados. El aumento energético requerido para esta promoción electrónica se verá compensado por la formación posterior de 4 enlaces en lugar de 2.
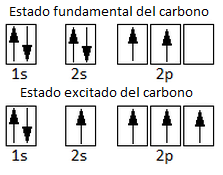
Ahora, considerando que la molécula de eteno es plana y forma ángulos de 120º, esto es congruente con la hibridación sp2. Recordemos que en efecto la hibridación sp2 de la molécula de BF3, que en efecto tiene ángulos de 120º y enlaces en un mismo plano. Como hemos dicho, para formar doble enlace el carbono necesita tener un orbital p sin hibridar. Por esto, se hibridarán el orbital 2s y 2 de los orbitales p:
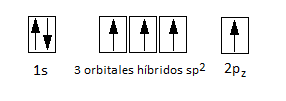
Los tres orbitales híbridos sp2 se dirigen hacia los vértices de un triángulo equilátero hipotético, mientras que el orbital p sin hibridar queda perpendicular al plano de los híbridos, con un lóbulo por encima y otro por debajo del plano de los mismos. Esta hibridación la presentarán ambos carbonos que forman el enlace doble del eteno y explica por qué la geometría de la molécula es plana.
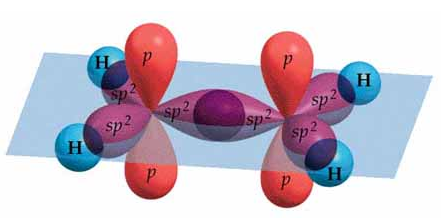
Imagen procedente de https://wps.prenhall.com
Asimismo, cabe destacar que como ahora los enlaces que unen a los dos carbonos son 2, un enlace de tipo sigma, σ, y un enlace de tipo pi, π, estarán más estrechamente unidos que en el caso del enlace simple y se hallarán más cercanos entre sí. Mientras que la distancia de un enlace simple carbono-carbono es de 0,154 nm, en un enlace doble carbono-carbono es de 0,134 nm.
Además, mientras que un enlace simple carbono-carbono tiene una cierta libertad de rotación sobre sí mismo (en el eje que une ambos carbonos), no sucede así con el enlace doble. El enlace doble es rígido, porque los orbitales p solapan lateralmente, con un ángulo muy preciso. Si rotase, se rompería el enlace π porque los orbitales p dejarían de solapar. Esta rigidez hace también que si hay un sustituyente distinto del hidrógeno en cada carbono, por ejemplo en el caso del 1,2-dicloroeteno, las propiedades de la molécula varíen según la posición de dichos sustituyentes, dando lugar a los llamados isómeros geométricos.
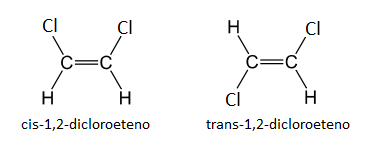
Esto se diferencia con los prefijos cis y trans. Si los dos sustituyentes están en el mismo lado del doble enlace, recibe el nombre de cis, y si están en lados opuestos, de trans.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente, Geometría molecular e hibridación y Modelo enlace de valencia.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola!
So yo otra vez ji ji ji… donde puedo encontrar los ejercicios de Enlace Quimico? despues de ver tus magnificos video estoy lista para muchos ejercicios ji ji ji
Muchas Gracias! 🙂
dg, 13 Años Antes
Jajaja, te veo dando el 100% 😀 Pues los ejercicios de enlace todavía no están listos, igual que enlace metálico e iónico. Es que precisamente estoy ahora en este tema, en enlace (ya habrás visto que los vídeos de hibridación los subí la semana pasada básicamente), y aún tengo que grabar todos los contenidos restantes.
No obstante, ¿tienes enunciados tuyos de clase? Puedes intentarlos y si tienes dudas preguntarme en tanto que yo voy preparando los ejercicios, que seguramente se alargará un poquito porque no tengo demasiado tiempo.
Un saludo enorme y gracias por la confianza 😀
¡Estudia mucho!
Quimitube, 13 Años Antes
Muchas gracias! esperare muy anciosa los videos de enlace ionico y metalico!
En mi casa ya todos votamos en Bitacoras por tu web.
Mucha suerte! 🙂
dg, 13 Años Antes
A ver si hay suerte y este fin de semana caen unos cuantos vídeos de enlace.
En cuanto a lo de los premios, ¡guau! ¡Gracias! ¡Muchas gracias! 😀
Acaba de salir la sexta clasificación provisional (cómo prolongan la agonía) y seguimos segundos, gracias a vuestros votos.
Un saludo enorme,
Carmen
QuimiTube, 13 Años Antes
Muchas gracias por tu vídeo , me ha ayudado muchísimo para terminar de comprender la hibridación sp2 del eteno , lo que no he encontrado que si me hubiera gustado son ejercicios de estequiometría para hacer , pero aun así te felicito por la página no tienes un 10 tienes un 20.
David, 13 Años Antes
¡Hola David! Bienvenido. Gracias por tu comentario, nos hace mucha ilusión que te sirva de ayuda porque estamos trabajando mucho… Como verás vamos añadiendo poco a poco el temario, así que estequiometría también llegarán, aunque será un poquito más adelante (sólo tenemos algunos ejercicios de estequiometría rédox y de ácido base, pero estequiometría en sí misma no). De todas formas, aunque no veas vídeos de estequiometría aún, puedes preguntar cualquier duda al respecto. Un saludo enorme y gracias de nuevo por tu comentario 😀
QuimiTube, 13 Años Antes
Pues Gracias Por Enseñarnos lo que no sabemos nos an ayudado mucho:3*—–*♥:$jejeexD
Leidy Denisse Bozada Herrera, 12 Años Antes
¡De nada! 😀
QuimiTube, 12 Años Antes
Feliz año 2013 y muchísimas gracias por esta página que me está siendo de gran ayuda para entender la teoría de la hibridación y otros aspectos de la química:). Quería preguntar si la hibridación del O2 sería con tres orbitales híbridos sp2 y un orbital p en cada oxígeno de manera que se formara un doble enlacesigma sp2-sp2.
Muchas gracias otra vez.
Esther, 12 Años Antes
Hola Esther, me alegro de que te sirva y te guste 🙂 Sí, en la molécula de oxígeno puedes plantear una hibridación sp2 en un plano, de forma que un híbrido sp2 de un oxígeno y un sp2 del otro formen enlace sigma frontal, mientras que los dos p si hibridar solaparían lateralmente. Sin embargo, para explicar la molécula de oxígeno en realidad no sería necesario recurrir a la hibridación para explicar la molécula de O2, bastaría considerar que dos orbitales p solapan frontalmente para dar el sigma y otros dos perpendiculares a estos solapan lateralemente para dar el enlace pi. Un saludo grande.
QuimiTube, 12 Años Antes
Muchas gracias ! Sos una genia !!! Muchos profesores deberian aprender a explicar como vos !! Te felicito !!
Laura, 12 Años Antes
¡Muchas gracias Laura! Bienvenida 🙂
QuimiTube, 12 Años Antes
¡ME ENCANTA COMO EXPLICAS! ME SIRVIÓ MUCHO PARA MI CLASE, GRACIAS<3
Juanita, 12 Años Antes
Muchas gracias, me alegro mucho de que te sirva y te agradezco que hayas pasado por aquí a dejar tu comentario. Un saludo grande.
QuimiTube, 12 Años Antes
excelente
jhonny, 12 Años Antes
A muchas personas nos resulta de gran utilidad el tiempo que inviertes en esta página. De verdad que se agradece encontrar personas que dediquen todo este trabajo a ayudar a los demás,y que además lo haga tan bien. Gracias.
sara, 11 Años Antes
Muchas gracias Sara, me ha emocionado tu comentario. Me alegra que sirva a tanta gente, el trabajo realizado vale la pena multiplicado por mil. Un saludo muy grande.
QuimiTube, 11 Años Antes
muy bueno pero porfavor puedes subir las referencias???
Rodolfo Missael, 11 Años Antes
Muy buenos los vídeos me sirven de mucho
Tengo una duda, nose donde ponerla así que la pongo aquí, el CO2 que tipo de hibridación sería sp o sp2???
Rafa, 11 Años Antes
¡Hola! La hibridación del carbono en el CO2 es sp porque es lineal, ya que forma dos dobles enlaces. Hay dos posibilidades para que un átomo de carbono presente hibridación sp: que tenga un triple enlace y un simple, o que tenga dos dobles enlaces. Un saludo.
QuimiTube, 11 Años Antes
No sabes lo agradecida que te estoy por este fantástico video.. ME ha ayudado muchísimo. Resulta que en dos días tengo el examen y ya estoy preparada para sacar un 10 gracias a tu ayuda. Muchos besos ♥
Carmen Rocío, 10 Años Antes
¡Muchísima suerte con ese examen! Espero que saque el 10 como recompensa por tu esfuerzo. Un abrazo grande.
QuimiTube, 10 Años Antes
exelente explicación. Realmente tu trabajo es estupendo 🙂 . Esto ayudo, ayuda y ayudará a muchas personas. Gran contribución!
Cristian, 10 Años Antes
Muchisimas gracias por todos los videos! Estais ayudandome a mi y a mis amigas un montón en la carrera y eso que ya estamos en la Universidad!
Lo que no acabo de entender de este apartado es porqué están los orbitales hibridos sp2 en el mismo plano…
Maria, 10 Años Antes
¡Hola Maria! Me alegra mucho que os sirva 😀 Están en el mismo plano porque separarse entre sí 120º hace que la repulsión electrónica sea mínima, por lo que dicha disposición de los 3 híbridos sp2 es la más favorable energéticamente (en todo proceso físico hay que buscar siempre que la energía sea favorable). Un saludo grande.
QuimiTube, 10 Años Antes
Hola, acabo de ver el vídeo, pero no me queda clara una cosa, siempre que haya un doble enlace según lewis, habrá hibridaión sp2?? Gracias 🙂
Nerea, 10 Años Antes
¡Hola! Si un carbono forma un enlace doble y dos simples siempre será hibridación sp2. Ahora bien, si formase dos enlaces dobles, sería hibridación sp como cuando forma un enlace triple.
QuimiTube, 5 Años Antes
buenas noches, es excelente su forma de explicar, aunque todavía tengo una duda, para hacer la hibridación del CH2=C=CH2 no he encontrado como hacerla, ¿cómo se realiza su hibridación?
Miguel Angel, 9 Años Antes
Hola Miguel Ángel, muchas gracias. Cuando tienes un átomo de carbono con dos dobles enlaces su hibridación es sp, sería similar al etino, pero en lugar de formar los dos enlaces pi con el mismo carbono forma uno con un carbono de cada lado. Un saludo.
QuimiTube, 9 Años Antes
Hola , debo agradecerte por la manera que tienes de explicar cada vídeo , haces que sea mucho mas claro los conceptos.Soy estudiante de Biología y hay que saber que la Química es una herramienta muy fundamental en todos los estudios de procesos biológicos.
Gracias por el gran aporte que das. Saludos desde Perú.
Juan Chunga, 9 Años Antes
¡Muchas gracias Juan! Me alegra que te sirviera el material. Un saludo.
QuimiTube, 9 Años Antes