¿Qué es la cinética química y por qué es tan importante?
Escrito por Quimitube el 20 agosto
Cuando en química se estudia una reacción determinada, interesan, además de la propia ecuación química (los reactivos y los productos que intervienen y en qué proporciones) dos aspectos fundamentales. Un primer aspecto es el termodinámico y, un segundo, el cinético.
Estudio termodinámico de las reacciones químicas
El aspecto termodinámico nos indica si la reacción es favorable o desfavorable energéticamente. Si una reacción es energéticamente favorable y ΔG < 0, la reacción será espontánea, es decir, en cuanto los reactivos se pongan en contacto, la reacción comenzará a producirse dando lugar a los productos. Es importante determinar si una reacción química es o no espontánea para saber si se podrá emplear, por ejemplo, en un proceso industrial, o si tendrá repercusión real en un posible fármaco, proceso medioambiental… Para determinar esto, calculamos la diferencia que hay entre la energía libre de reactivos y productos, como vemos en los diagramas siguientes:
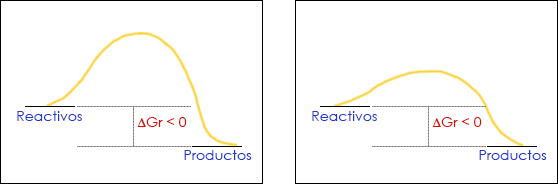
Dos reacciones químicas con la misma espontaneidad (misma diferencia de energía libre de Gibbs entre reactivos y productos) pueden tener velocidad de reacción distinta, es decir, distinta cinética química, si la energía de activación es también distinta.
Los perfiles energéticos de la figura representan dos reacciones químicas distintas que tienen la misma espontaneidad, ya que su diferencie energética entre reactivos y productos es la misma en ambos casos. Sin embargo, basta ver los diagramas por encima para darnos cuenta de que no son idénticos. Se diferencian en su cinética química.
Estudio cinético de las reacciones químicas
Como vemos en el apartado previo, en el estudio termodinámico de una reacción nos interesa ver que los productos tienen una energía libre menor que los reactivos, lo cual hará que la reacción sea espontánea. Sin embargo, hemos puesto dos ejemplos de diagramas de dos reacciones químicas distintas, ambas espontáneas. A pesar de corresponder ambos a procesos energéticamente favorables, tienen una diferencia muy clara: la montaña amarilla que separa reactivos de productos no tiene la misma altura. La diferencia entre la energía de los reactivos y la cima de la montaña se denomina energía de activación, y cuanto más pequeña sea mayor será la velocidad de reacción. Es decir, la magnitud de la energía de activación nos indica el aspecto cinético de la reacción química, la velocidad a la cual transcurre una reacción. Así, podemos definir la cinética química como el estudio de la velocidad a la cual transcurren las reacciones químicas y de los factores que influyen en ella, como concentraciones, naturaleza de los reactivos o la presencia de catalizadores.
Podemos determinar con los tres diagramas siguientes cuál de las reacciones tendrá, comparativamente, una velocidad menor y cuál una velocidad mayor.
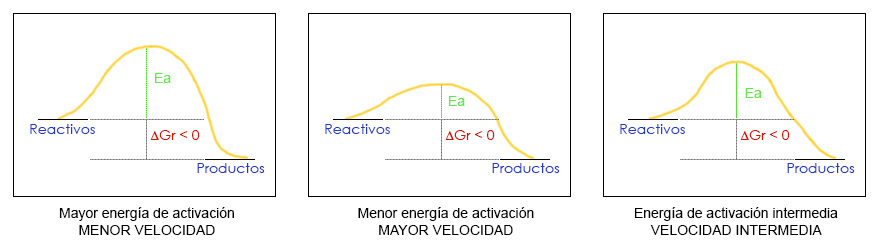
La variación de energía libre negativa de una reacción química nos indica que una reacción será espontánea pero no a qué velocidad transcurrirá. Para saber la cinética química de la reacción debemos fijarnos en la barrera de potencial, es decir, la energía de activación (Ea) o la cima de la montaña. Cuanto más alta es esta barrera, menor será la velocidad de reacción porque resulta más costoso para el sistema.
¿Por qué es importante la cinética química?
Como hemos visto considerando los dos aspectos, cinético y termodinámico, el hecho de que una reacción sea energéticamente favorable no implica que sea rápida. Una reacción puede ser espontánea pero terriblemente lenta, incluso no transcurrir en un período de tiempo apreciable para nosotros. Por ejemplo, si nos regalasen un diamante al nacer, nos haríamos viejos y nos marcharíamos de este mundo sin ver cambios en ese diamante, a pesar de que su conversión en grafito es una reacción espontánea. El grafito es termodinámicamente más estable pero la reacción es extremadamente lenta.
C diamante → C grafito ΔG < 0
Esto hace que el estudio de la velocidad de reacción sea determinante en multitud de procesos: no solo debemos saber (o medir experimentalmente) a qué velocidad transcurre una determinada reacción química, sino también cómo influir en ella. Conocer los factores que afectan a la velocidad de reacción hace que podamos hacer que una reacción indeseada sea más lenta (la putrefacción de los alimentos se ralentiza al bajar la temperatura en el frigorífico o en el congelador) o más veloz (los catalizadores, sustancias que aceleran las reacciones químicas, pueden ayudar a que una reacción transcurra en una fracción de segundo, por ejemplo los enzimas en nuestro organismo o el platino en la producción de algunos compuestos industriales).
Imaginad por un momento que un fármaco para el dolor de cabeza tardase tres días en hacer efecto (seguramente a esas alturas ya no tendríamos dolor de cabeza, pero lo habríamos pasado mal) o que nuestro sistema digestivo tardase una semana en digerir los alimentos que ingerimos. Sin una cinética química adecuada, los seres vivos en sí seríamos sencillamente inviables.
También te puede interesar:
Tema completo de cinética química: teoría y ejercicios





[…] La cinética química es la rama de la química que estudia la velocidad de las reacciones químicas. Su estudio es muy importante. […]
¿Qué es la cinética qu&iac..., 11 Años Antes
[…] nuestra última entrada del blog, estuvimos hablando de qué es la cinética química y de por qué es importante su estudio dentro […]
Cinética química de la reacción de peroxodisulfato con yoduro | Quimitube, 11 Años Antes