Reacciones endergónicas y exergónicas
Escrito por Quimitube el 28 julio
Es muy habitual en termoquímica, y en química en general, clasificar las reacciones químicas como endotérmicas o exotérmicas. Estas definiciones vienen dadas en función de la variación de entalpía de la reacción en unas determinadas condiciones de presión y temperatura (normalmente condiciones estándar o condiciones normales). Así, tenemos:
– Reacción endotérmica: es aquella cuyo valor de entalpía es positivo, es decir, el sistema absorbe calor del entorno (ΔH > 0).
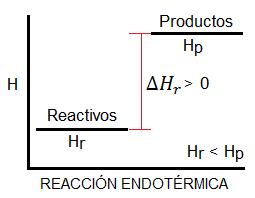
– Reacción exotérmica: es aquella cuyo valor de entalpía es negativo, es decir, el sistema desprende o libera calor al entorno (ΔH < 0).
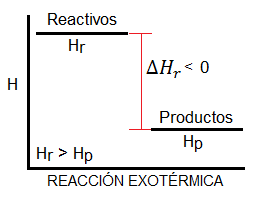
Sin embargo, las reacciones pueden clasificarse también en función de su variación de energía libre, DG, parámetro fundamental para determinar si una reacción química es o no espontánea (como puedes ver explicado con mayor profundidad aquí). Y esta clasificación también tiene su propio nombre, aunque mucho menos utilizados que los de exotérmica y endotérmica. En función de la energía libre, las reacciones químicas se clasifican como «endergónicas» y «exergónicas». En este caso se tiene en cuenta el balance entre la entalpía y la entropía, es decir, el cálculo de la energía libre de Gibbs se realiza como:
ΔG = ΔH – TΔS
Y así:
– Reacción endergónica: es aquella reacción química en la cual la variación de energía libre de Gibbs es positiva. Por tanto, se tratará de una reacción desfavorable o no espontánea. Si consideramos condiciones estándar de presión y temperatura, tenemos:
ΔGo > 0
– Reacción exergónica: es aquella reacción química en la cual la variación de energía libre de Gibbs es negativa. Se trata, así, de una reacción espontánea (aunque recordemos que la espontaneidad no nos dice nada acerca de la velocidad a la cual se producirá la reacción química, es decir, de la cinética química). En condiciones estándar de presión y temperatura, por tanto, tendremos:
ΔGo < 0
Esperamos que este apunte os sirva para recordar que «reacción endergónica» y «reacción exergónica» son también conceptos válidos y adecuados para una explicación precisa en termoquímica.





Información Bitacoras.com
Valora en Bitacoras.com: Es muy habitual en termoquímica, y en química en general, clasificar las reacciones químicas como endotérmicas o exotérmicas. Estas definiciones vienen dadas en función de la variación de entalpía de la reacción en unas deter..…
Bitacoras.com, 10 Años Antes