Contenido del Vídeo
La expresión de la ley de acción de masas aplicada a una reacción que no ha alcanzado aún el equilibrio se denomina cociente de reacción, Qc, y nos permite determinar hacia dónde se desplazará la reacción para alcanzar el equilibrio. Para la siguiente reacción:
aA + bB ⇔ cC + dD
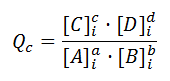
Donde las concentraciones no son las del equilibrio, sino otras concentraciones dadas, generalmente las iniciales, que en la fórmula hemos indicado con el subíndice i. Así, comparar Qc con Kc en un momento dado nos permite averiguar el estado y evolución del sistema:
- Si el cociente de reacción es igual a la constante de equilibrio, Qc = Kc, el sistema ya ha alcanzado el equilibrio químico y permanecerá así si no variamos las condiciones, como por ejemplo la temperatura.
- Si el cociente de reacción es menor que la constante de equilibrio, Qc < Kc, el sistema evolucionará hacia la derecha (predomina la reacción directa) para aumentar la concentración de productos.
- Si el cociente de reacción es mayor que la constante de equilibrio, Qc > Kc, el sistema evolucionará hacia la izquierda (predomina la reacción inversa) para aumentar la concentración de reactivos.
Por ejemplo, considerando la reacción:
H2(g) + I2(g) ⇔2HI(g)
A 448ºC, Kc = 50
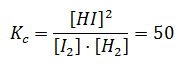
Si se introducen en un recipiente las siguientes concentraciones:
[H2]i = 2M, [I2]i = 2M, [HI]i = 1M
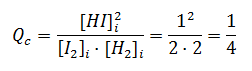
Qc < 50, el sistema evolucionará hacia la derecha, hacia la formación de HI.
Pero si se introducen inicialmente en el recipiente estas otras concentraciones:
[H2]i = 2M, [I2]i = 2M, [HI]i = 20M
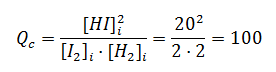
Qc > 50, el sistema evolucionará hacia la izquierda, hacia la descomposición de HI para dar nuevamente I2 y H2.
También te puede interesar:
Equilibrio químico teoría 2: Constante de equilibrio Kc.
Category: Equilibrio Químico, Teoría de Equilibrio Químico y Vídeos Equilibrio Químico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
No llego a comprender el por qué si el cociente de reacción es menor que la constante de equilibrio, el sistema evoluciona a la derecha. ¿Se deben igualar Qc y Kc, por ello evoluciona hacia la derecha? ¿Lo mismo ocurre hacia la izquierda? Muchas gracias por todo lo que hace. Saludos desde Valencia.
Alba, 10 Años Antes
Hola Alba, efectivamente cuando un sistema no se encuentra en equilibrio siempre evolucionará para alcanzarlo, lo cual significa que Qc va cambiando su valor hasta que se iguala a Kc. Así, si es menor de lo que debería, «necesita» aumentar el numerador (los productos) para llegar al valor de Kc que es superior, y por ello evoluciona a la derecha. Si por el contrario es superior a Kc, «necesita» reducir el valor del numerador y aumentar el del denominador (los reactivos) y por ello evoluciona hacia la izquierda. Una vez que alcance el equilibrio y su valor de Qc sea igual a Kc, permanecerá así indefinidamente a no ser que se cambie algún factor externo como por ejemplo la temperatura o la presión. Espero haber aclarado tu duda. Un saludo grande.
QuimiTube, 10 Años Antes
Hola, yo no tengo ninguna duda en particular, solamente queria agradecer por las explicaciones y el esfuerzo dedicado. Comento aqui como podria haber agradecido en cualquier otro tema. Me viene sirviendo mucho.
Muchas gracias de verdad, saludos desde Argentina,
Matias.
Matias, 9 Años Antes
Mil gracias Matías por tomarte tu tiempo para dejar este comentario de agradecimiento, me ayuda mucho a seguir con la página. Un saludo grande.
QuimiTube, 9 Años Antes