Contenido del Vídeo
Un modo de visualizar las características energéticas de los enlaces químicos es a partir de las llamadas curvas de estabilidad energética o curvas de Morse. Estas curvas se pueden hallar experimentalmente, y representan la variación de energía de un sistema formado por dos átomos, A y B, en función de la distancia d que los separa. Como podemos ver en el diagrama siguiente, en el eje y se representa la energía y en el eje x se representa la distancia.
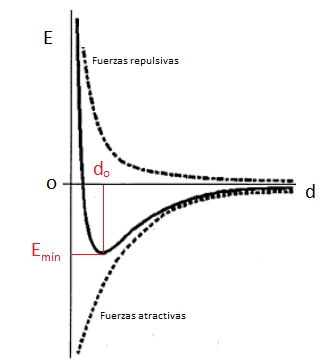
Curvas de Morse
Si consideramos un sistema formado por dos átomos, A y B, inicialmente tan separados que no ejercen entre sí ningún tipo de influencia, el sistema tiene una energía inicial cero. A medida que A y B se empiezan a aproximar mutuamente, empiezan a notarse las fuerzas atractivas, que son de largo alcance. ¿Qué fuerzas atractivas? Pues la del núcleo de A sobre la nube electrónica de B y viceversa, la del núcleo de B sobre la nube electrónica de A. Puesto que esto estabiliza el sistema, la energía del mismo disminuye hasta un valle de mínima energía. No obstante, a medida que A y B siguen acercándose, empiezan a dejarse notar las fuerzas repulsivas (de corto alcance) de una nube electrónica sobre la otra, lo cual desestabiliza el sistema y la energía aumenta hasta alcanzar, incluso, valores positivos.
El resultado conjunto de las fuerzas atractivas y repulsivas permite dibujar la curva de estabilidad energética del enlace químico o curva de Morse. En ella se puede observar que existe una distancia de enlace entre A y B para la cual el sistema es más estable, pues en ese punto, las fuerzas atractivas son máximas y las repulsivas mínimas. Esta es la llamada distancia de enlace, do. A dicha distancia le corresponde un valor de energía mínimo que identificamos con la energía de enlace, es decir, la energía que se desprende cuando se forma el enlace químico entre A y B. Cuando mayor es el valor de la energía desprendida al formarse el enlace, más estable será el enlace y, por tanto, más estable será la molécula A-B. Para romper dicha molécula será necesario aportar una energía igual o superior a la energía de enlace, lo cual implica separar A y B desde do a una distancia a la cual ya no ejerzan ningún tipo de interacción mutua.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Conceptos generales de enlace químico y Enlace covalente.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Sabes cuales so las ecuaciones de potencial que describen los enlaces, como por ejemplo la ecuación de Lannard-Jones.
De antemano muchas gracias.
Juan Alberto Vera Herrera, 12 Años Antes
Hola Juan Alberto, estas ecuaciones que comentas son más del área universitaria de química física y de momento exceden el nivel académico de nuestra página. Un saludo.
QuimiTube, 12 Años Antes
Si bien soy técnico quimico, tus explicaciones me han servido mucho pues son en verdad muy claras y entendibles, lo que las hace asequibles al publico en general.
Y además eres hermosa.
Saludos desde Argentina
marcelo, 12 Años Antes
Muchísimas gracias Marcelo, bienvenido.
QuimiTube, 12 Años Antes
creo que estoy enamorado
pablo, 12 Años Antes
Saludos estimada profesora, deseo consultarle acerca de la representación algebraica que tiene esa curva de morse, de la que hace referencia en su vídeo. Y le pregunto además, ¿Cree usted que sea posible tener acceso a alguna referencia bibliográfica que me permita conocer dicha trayectoria?
Agradecido de antemano por su gentileza, me despido.
Atte. Walter chambio.
Walter, 10 Años Antes
Hola Walter, no conozco ningún libro en concreto, pero cualquier libro de química general seguramente lo incluirá y, si no es así, te sugiero que busques en un libro de fundamentos de química física o de mecánica cuántica, donde estará sin lugar a dudas con la expresión algebraica correspondiente para moléculas diatómicas sencillas como H2.
QuimiTube, 10 Años Antes