Contenido del Vídeo
En este ejercicio calcularemos el porcentaje de carácter iónico de algunas moléculas covalentes en función de dos parámetros: el momento dipolar y la distancia internuclear o distancia de enlace. Para ello debemos tener en cuenta la siguiente fórmula:
μ = q·d
Donde μ es el momento dipolar, q es el desplazamiento de carga del enlace en cuestión y d la distancia de enlace. Consideraremos que, si el enlace fuese 100% iónico, el desplazamiento de carga sería el equivalente a la carga neta de un electrón, es decir, 1,60·10^(-19) C, y calculando la carga desplazada real podremos determinar qué porcentaje de carácter iónico tiene el enlace.
El enunciado completo es:
Calcular el tanto por ciento de carácter iónico de los siguientes compuestos:
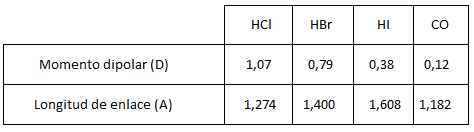
Existen otras formas de calcular el tanto por ciento de carácter iónico, como la fórmula empírica de Linus Pauling que utilizaremos en el ejercicio 10.
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Enlace covalente y Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
¡Buenas de nuevo, Carmen! 😀
Quería hacerte un par de consultas.
Una de ellas tiene que ver con que no acabo de entender por qué dividimos por la carga del electrón para obtener el tanto por ciento de carácter iónico. ¿Se supone que tomamos la carga del electrón como si fuera equivalente al cien por cien de carácter iónico?
La otra es sobre un ejemplo resuelto del libro de texto en el tema de cinética (benditos ejemplos resueltos que me vuelven loca, jajaja). Verás, el caso es que el enunciado dice lo siguiente: «Experimentalmente, se determinó que la reacción 2A + B —> P sigue la ecuación de velocidad v=k [B]2 (al cuadrado). Conteste razonadamente si les proposiciones siguientes son ciertas o falsas: La velocidad de desaparición de B es la mitad de la velocidad de formación de P.» y responden diciendo que es cierto porque v= -1/2 · d[A]/dt = -d[B]/dt. No sé si es que yo no lo estoy entendiendo bien o si es que puede haber algún error en el libro porque teóricamente el siguiente término sería que eso es igual a d[P]/dt según la fórmula, ¿no? Yo interpreto que las velocidades de desaparición de B y de formación de P son iguales. ¿Podrías explicármelo brevemente, por favor?
Muchas gracias.
Ana, 12 Años Antes
Hola, quisiera saber en que libro puedo encontrar las tablas con todos los momentos dipolares, pueden ayudarme por favor, muchas gracias. Saludos desde Colombia
Alejandra, 10 Años Antes
Lo lamento Alejandra, desconozco dónde podrías encontrarlo, creo que más que en un libro lo encontrarás en artículos especializados en los que los investigadores hayan calculado gran cantidad de momentos dipolares para distintas moléculas.
QuimiTube, 10 Años Antes