Contenido del Vídeo
Cuando se modifican una o más variables en un sistema que se encuentra en equilibrio químico, dicho equilibrio experimenta un cambio y se desplaza, es decir, se modifican las proporciones de reactivos y productos existentes. Estos cambios se pueden interpretar de forma cualitativa mediante el llamado Principio de Le Châtelier, enunciado en 1885, el cual se puede enunciar como:
«Cuando en un sistema en equilibrio se produce una modificación de alguna de las variables que lo determinan (concentración, presión y temperatura) el equilibrio se desplaza en el sentido en el que se opone a dicha variación».
En este primer vídeo de los 3 que conforman el apartado 7 de teoría de equilibrio químico, sobre los factores que modifican el equilibrio, vamos a estudiar cómo afecta al equilibrio químico una modificación de la concentración de reactivos o de productos.
Consideramos la siguiente reacción reversible:
N2(g) + O2(g) ⇔ 2NO(g)
Cuando se alcanza el equilibrio químico, se cumple:
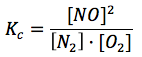
Si en este momento y a temperatura constante se introduce en el reactor cierta cantidad adicional de oxígeno, el sistema dejará de estar en equilibrio, pues se habrá modificado la concentración de O2 y la expresión anterior ya no será igual a Kc, sino a Qc, con concentraciones que ya no corresponden a las del equilibrio:
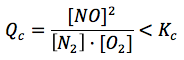
Esta expresión será ahora menor que Kc porque al aumentar [O2] aumenta el denominador y por tanto disminuye el cociente.
Para restablecer el equilibrio, el sistema ha de evolucionar reajustando las concentraciones para que su cociente vuelva a ser igual a Kc. Para ello, como Qc < Kc, es necesario que aumente el denominador, es decir, [NO]. El sistema evolucionará hacia la derecha, una cierta cantidad de N2 y de O2 reaccionan para producir más NO y reajustar el cociente de concentraciones.
Se dice que el equilibrio se ha desplazado hacia la derecha.
En general, para una reacción:
aA + bB ⇔ cC + dD
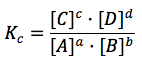
Un aumento de A o de B (o de ambos) aumenta el denominador, lo que hace que Qc < Kc, y que la reacción se desplace hacia la derecha, hacia la formación de C y D.
- En general, un aumento de las concentraciones de reactivos o una disminuación de las concentraciones de productos, desplaza la reacción hacia la derecha.
Por el contrario, un aumento de las concentraciones de C o de D (o de ambos) hace que aumente el numerador y que Qc > Kc, y que la reacción se desplace hacia la izquierda, hacia la formación de A y de B.
- En general, un aumento de las concentraciones de productos o una disminución de las concentraciones de reactivos, desplaza la reacción hacia la izquierda.
La variación de las concentraciones de reactivos o de productos se usa frecuentemente en la industria para obtener mayor cantidad de un producto deseado. Por ejemplo:
N2(g) + 3H2(g) ⇔ 2NH3(g)
Un aumento de las concentraciones de N2 y H2 desplaza el equilibrio en sentido contrario, hacia el amoníaco, que es el producto de nuestro interés.
En los ejercicios resueltos del tema trataremos en mayor profundidad con distintas reacciones reversibles la aplicación del Principio de Le Châtelier cuando se modifican las concentraciones de reactivos o de productos.
Category: Equilibrio Químico, Teoría de Equilibrio Químico y Vídeos Equilibrio Químico.
Etiquetas: Principio de Le Châtelier.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
¡Gracias! Esta muy buena esta información y muy bien explicada. Los felicito.
Luisiana, 8 Años Antes