Contenido del Vídeo
Explicación teórica de las Valoraciones Ácido-Base o Volumetrías de Neutralización, procedimiento analítico cuantitativo basado en la reacción de neutralización, de gran utilidad para determinar la concentración de ácido o de base de una muestra problema.
Las valoraciones ácido-base son un procedimiento cuantitativo de análisis que pretende determinar la concentración de ácido o de base de una disolución cuya concentración desconocemos. Para ello lo que vamos a hacer es utilizar una disolución valorante de la que sí conocemos la concentración, de forma que añadiendo una cantidad de volumen conocida de la disolución valorante podremos saber, por estequiometría, qué concentración tenemos en al disolución problema. Tenemos el siguiente montaje con una bureta (que contiene la disolución valorante) y un erlenmeyer (que contiene un volumen conocido de la disolución problema a determinar):
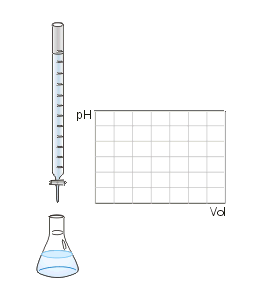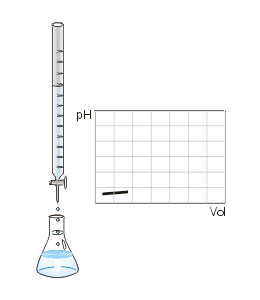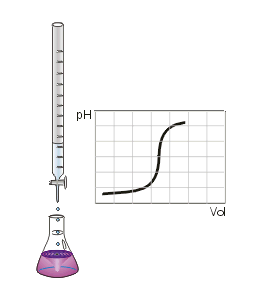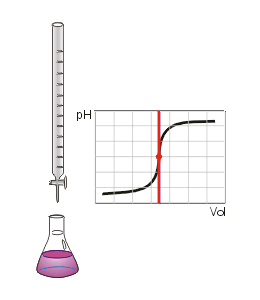
Valoración ácido-base. Fuente: Wikipedia. Dominio público.
Para el procedimiento de valoración vamos a ir añadiendo lentamente disolución valorante en el matraz erlenmeyer que contiene la muestra problema, hasta que hayamos introducido la misma cantidad de moles que teníamos inicialmente.
Imaginemos que estamos valorando HCl (ácido clorhídrico) con NaOH (hidróxido sódico). En el erlenmeyer tendremos una cierta cantidad de moles de H3O+ procedentes del ácido (nH3O+), y la neutralización será completa (habrá finalizado) cuando hayamos introducido en el matraz el mismo número de moles de iones hidróxido, n(OH–).
La reacción de neutralización será:
H3O+ + OH– → 2H2O
O también:
HCl + NaOH → NaCl + H2O
Cuando ocurre que:
n(H3O+) = n(OH–)
Decimos que hemos llegado al Punto de Equivalencia.
Si somos capaces de determinar dicho Punto de Equivalencia, entonces podremos determinar la concentración de la disolución de concentración desconocida que tenemos en el matraz erlenmeyer, lo cual constituye la finalidad del procedimiento de titulación.
¿Y cómo podemos determinar el Punto de Equivalencia? Como las disoluciones en su mayor parte son transparentes, por mucho que yo vaya añadiendo base (valorante) no voy a ver cambios en la disolución que me permitan determinar que ya he alcanzado dicha equivalencia y que ha acabado mi valoración. Para lograr determinar el Punto de Equivalencia podemos hacer dos cosas:
- Utilizar un pHmetro, equipo que mide el pH de forma continua y en tiempo real con un electrodo.
- Incluir unas gotas de lo que denominamos indicador ácido base. Se trata de una sustancia que cambia de color en las proximidades de punto de equivalencia. Uno de los indicadores más utilizados en estas valoraciones es la fenolftaleína, cuyo intervalo de viraje está entre 8,2 y 10,8.
Como vemos en la imagen anterior, donde se aprecia el montaje de una valoración, vemos también lo que denominamos Curva de Valoración. Dicha curva representa el pH de la disolución problema a medida que vamos añadiendo volumen de valorante. Como se puede observar, en un momento dado se produce un salto brusco del pH. Si determinamos a qué volumen de valorante se ha producido el salto brusco, podré determinar el Punto de Equivalencia y por tanto calcular la concentración de la disolución problema.
También te puede interesar:
Teoría ácido-base 9: Reacciones de neutralización
Category: Teoría ácido base y Vídeos Ácido base.
Etiquetas: Valoraciones ácido base - Neutralización.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola tengo una duda respecto a esta valoración. En un laboratorio se preparo una solución 250 mil 0.1 N de ácido clorhídrico (concentrado 1.19 gr/m; y 37 % peso).En un matraz se puso carbonato de sodio con 100 ml de agua destilada. Y se empieza a valorar con el ácido. y me preguntan lo siguiente. Si en una de las valoraciones realizadas se obtiene un gasto de 24 ml de HCL y se midieron 0.1321 gr de carbonato de sodio. Cual es la concentración del Hcl valorado??
Sebastian, 12 Años Antes
Hola! tengo una duda muy grande…como sé qué indicador tengo que usar? Eso no me ha quedado para nada claro. Muchas gracias :)))
Isabel, 11 Años Antes
¡Hola! Te recomiendo ver el vídeo sobre indicadores ácido-base:
http://www.quimitube.com/videos/teoria-8-indicadores-acido-base/
Debemos usar un indicador que vire en una zona próxima al punto de equivalencia de la disolución. Cuando es ácido fuerte – base fuerte, como el caso de este vídeo, el punto de equivalencia está en pH = 7. Así, la fenolftaleína, que vira en 8,2-10, es adecuada para esta valoración porque vira próxima a 7. También te podría servir, por ejemplo, el rojo de fenol (verás los intervalos de viraje en el pie de vídeo de indicadores que te he enlazado).
Un saludo grande.
QuimiTube, 11 Años Antes
Muchísimas gracias! <3
Isabel, 11 Años Antes
De nada 🙂
QuimiTube, 11 Años Antes
Hola buenas!! me encantan tus vídeos, lo explicas todo de una manera mu fácil y comprensible jeje pero tengo una duda sobre la forma de resolver el problema. ¿este tipo de ejercicios se podría resolver también con la fórmula de: concentración inicial por volumen inicial es igual a concentración final por volumen final? siendo la concentración del HCl la concentración final
Esther, 11 Años Antes
¡Hola Esther! Mil gracias por tu comentario. Más que concentraciones iniciales y finales, la fórmula que comentas se aplica para la concentración de ácido y de base. Es decir: VHCl · MHCl = VNaOH · MNaOH. Como tienes 3 de los datos el tercero basta que lo calcules despejando. Un saludo grande.
QuimiTube, 11 Años Antes
hola, me preguntaba si para hallar el pH en el punto de equivalencia se puede usar que los reactivos se gastan por igual y entonces en el matraz lo que nos quedaria sera la sal y el agua y ya luego hidrolizas la sal y lo sacas. ¿Hay algun otro metodo?
Miguel Sanchez, 10 Años Antes
¡Hola! Esto que consideras es válido para valoraciones en las que tengas hidrólisis, es decir, que no provengan de ácido y base fuertes. En cambio en este ejemplo no tienes este caso, calcularías o bien por estequiometría o bien aplicando la fórmula Vácido·Nácido = Vbase·Nbase
QuimiTube, 10 Años Antes
Hola! Tengo una duda respecto a los indicadores, particularmente la fenolftaleína, porque hoy compré ácido clorhídrico para hacer NaCl y me gustria emplear el indicador. Una vez la solución es neutralizada y quiero evaporqar el agua para obtener los cristales, ¿ puedo hacerlo aunque la fenolftaleína esté en la solución?
Francisco, 10 Años Antes