Contenido del Vídeo
En este ejercicio resuelto del tema de termoquímica vamos a predecir el signo de la variación de la entropía de una serie de procesos a partir de los estados de agregación de los productos y los reactivos que intervienen en dichos procesos. Para ello nos basaremos en lo que hemos visto en el vídeo de Teoría 19.2: Deducción cualitativa del signo de la entropía de reacción.
En primer lugar plantearemos y ajustaremos correctamente la reacción química de cada proceso y seguidamente determinaremos qué sucede en dicha reacción, si aumenta el desorden de reactivos a productos, ΔS>0, o bien si el desorden disminuye de reactivos a productos, ΔS<0.
El enunciado completo del ejercicio y su explicación escrita es:
Justificar el signo que cabe esperar para ΔS de los procesos siguientes:
a) Obtención de cloruro de litio a partir de litio sólido y Cl2
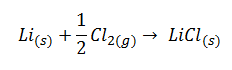
En este caso, tal y como explicaremos con detenimiento en el vídeo, el desorden disminuye, ΔS<0, ya que la entropía de los reactivos es mayor que la de los productos, pues el Cl2 se encuentra en estado gaseoso. Ya hemos visto en los correspondientes apartados de teoría que los gases tienen mayor desorden que los sólidos.
b) Sublimación del yodo
Para la reacción de sublimación del yodo, la entropía aumentará, ΔS>0, ya que pasamos de un sólido que es ordenado a un gas que es altamente desordenado. De hecho, siempre que tengamos un cambio de estado de sólido a gas podemos decir que el desorden aumenta. Para las condensaciones o solidificaciones pasa exactamente lo contrario, el desorden disminuye, ΔS<0.
c) Formación de amoniaco a partid de N2 y H2
Como todos los elementos son gases, podemos decir que ambos sistemas son altamente desordenados. Por ello, para determinar el signo de la ΔS lo que vamos hacer es calcular Δn, es decir, la variación del número de moles. De este modo podemos determinar si la entropía aumenta o disminuye siguiendo las siguientes pautas:
Si aumenta el número de moles, Δn>0, la entropía también aumenta.
Si el número de moles disminuye, Δn<0, también lo hará la entropía.
Así, para el caso de la formación de amoníaco aquí planteado, tal y como veremos con detenimiento en el vídeo, ocurre que:
![]()
Como Δn<0, tenemos que ΔS<0. El desorden disminuye, ya que pasamos de un mayor número de moles gaseosos en los reactivos a un número menor de moles gaseosos en los productos.
d) Descomposición de yoduro de hidrógeno para dar yodo e hidrógeno.
![]()
Este apartado lo realizaremos igual que en el apartado anterior:
![]()
Como en este caso tenemos que Δn=0, podemos decir que nuestra variación de entropía es muy pequeña, casi despreciable. Aunque siempre hay una pequeña variación, indicaremos que ΔS ≃ 0, es decir, la entropía prácticamente no variará, o al menos no podemos determinarlo de forma cualitativa.
e) Disolución de cloruro de sódico en agua
![]()
Tal y como hemos visto en el apartado de teoría, para la disolución de cualquier sal iónica la entropía aumenta, ΔS>0.
También te puede interesar:
Ejercicio 31 termoquímica: determinar qué sustancia tiene mayor entropía molar estándar
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Ejercicios de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
En el minuto 1:40 dices que un gas es una estructura muy ordenada… creo que esa afirmación es errónea no?
Anónimo, 12 Años Antes
Errónea sin duda, siento el lapsus 🙂 Un gas es una estructura desordenadísima y caótica.
Quimitube, 12 Años Antes
En el apartado e, en la disolución del NaCl en agua, se plantea la reacción química y los iones cloruro y sodio están separados por coma y entre paréntesis. ¿Qué significado tiene esto? ¿Se puede poner Na+ + Cl-? (sin coma ni paréntesis)
Sergio Cabrera, 11 Años Antes
En el caso de tener una reacción del tipo A(g) –> B(g) + C(s). ¿Qué signo tendría la entropía?
CL, 11 Años Antes
¡Hola! Aunque para predecirlo sería conveniente saber qué compuestos tienes, podríamos considerar que la entropía no variará porque 1 mol de gas A produce 1 mol de gas B, y seguirás teniendo la misma cantidad de gas inicialmente y al final. El sólido prácticamente no afectará a la variación de entropía.
QuimiTube, 11 Años Antes
Hola, disculpen tengo una pregunta. Soy estudiante de humanidades, asi que no se nada de moleculas ni esas cosas pero estoy escribiendo una novela sobre la entropia. Es una paradoja en una relacion amorosa. En mi novela la teoria es que los dos protagonistas tienen demasiadas diferencias entre ellos (desorden) y estan buscando un equilibrio (la segunda ley de la termodinamica se basa en el equilibrio la entropia y los procesos naturales de irreversibilidad) Entonces mis preguntas para no escribir una burrada son las siguientes… 1 – ¿Si aumenta la entropia… aumenta el desorden? ¿La entropia es generador de desorden? 2- Tambien lei que la entropia crece a lo largo del tiempo …. ¿entonces el desorden sera mayor a lo largo del tiempo? 3 – Yo necesito una solucion del desorden y el caos (para mi novela) en la entropia supuestamente todos los sistemas se transforman… por eso son irreversibles… Lei que un sistema en equilibrio se transforma en otro sistema de equilibrio… PERO….. ¿COMO VA A SER UN SISTEMA DE EQUILIBRIO UNO DONDE ABUNDA EL CAOS? ¿DONDE ESTA EL EQUILIBRIO EN LA ENTROPIA? espero me puiedan ayudar, al menos respondiendome algunas de mis preguntas…. (si las responden agradezco las ennumeren sino no entendere ni papa… muchas gracias)
Milagros, 10 Años Antes
¡Hola! Te respondo un poquito por encima:
1. Sí, aumenta el desorden. Aunque no es exacto, en muchos cursos académicos se define la entropía como el desorden, y un aumento del desorden implica un aumento de la entropía.
2. La entropía no para de crecer porque hay otras formas de energía que se pierden como entropía, por eso esta no para de crecer.
3. La entropía solo puede disminuir en un sistema si aumenta en el entorno de ese sistema. Si tienes una porción del universo donde ha disminuido, es porque hay otra porción del universo donde ha aumentado como mínimo en la misma magnitud y habitualmente más. En esa idea podrías abundar para lograr el equilibrio que buscas para tus personajes…
Un saludo.
QuimiTube, 10 Años Antes
ME PIDEN HALLAR LA ENTROPIA ABSOLUTA EN LA FORMACIÓN DEL METANOL EN LA SIGUIENTE REACCIÓN:
C + 2H2 + 1/2O2 = CH3OH
GRAFITO: 5,7 J/K
HIDROGENO: 130.45 J/K
OXIGENO: 2044.82 J/K
METANOL: 126.65 J/K
Ricardo, 10 Años Antes
Te recomiendo ver este vídeo:
http://www.quimitube.com/videos/termodinamica-teoria-19-1-como-calcular-la-variacion-de-entropia-de-una-reaccion-con-las-entropias-molares-estandar
QuimiTube, 10 Años Antes