Contenido del Vídeo
En este vídeo veremos cómo determinar el signo de la variación de entropía de algunos procesos y reacciones químicas a partir de ciertas consideraciones, entre las que se incluyen, esencialmente, las siguientes:
- La entropía de una mezcla de gases es mayor que la de dichos gases por separado. Así, si nosotros tenemos un recipiente de un litro que contiene un mol de hidrógeno, y otro recipiente de un litro que contiene un mol de argón, cuando se mezclan dichos gases en un recipiente de dos litros la entropía aumenta, a pesar de no haber aumento de la presión.
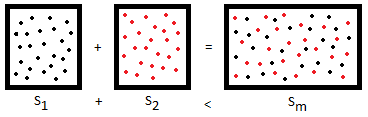
- La entropía de una disolución sólido-líquido es mayor que la del soluto y el disolvente por separado. Así, si nosotros disolvemos 10 gramos de cloruro sódico en 1 litro de agua, la entropía inicial del NaCl y del H2O es menor que una vez que hemos disuelto el soluto en el disolvente.
- En cambio, si se trata de disolver un gas en un líquido, la entropía de la disolución disminuye con respecto a la del gas y el líquido por separado. Esto es debido a que, en el seno del líquido, el gas tiene una menor libertad de movimiento que la que tenía inicialmente y, por tanto, su entropía disminuye.
- Si consideramos reacciones en las que intervienen gases, la entropía aumentará si aumenta el número de moles de gas de reactivos a productos; si disminuye el número de moles de gas de reactivos a productos, la variación de entropía será negativa (disminuye el desorden). Es decir:
ΔS > 0 si Δn > 0 (aumenta el número de moles de gas, aumenta el desorden)
ΔS < 0 si Δn < 0 (disminuye el número de moles de gas, disminuye el desorden)
Δn: variación del número de moles gaseosos de reactivos a productos
Otros vídeos relacionados que pueden interesarte:
Termodinámica Teoría 16: Espontaneidad de las reacciones químicas. Concepto de entropía.
Termodinámica Teoría 17: Segundo Principio de la Termodinámica. Entropía del Universo.
Termodinámica Teoría 18: Tercer Principio de la Termodinámica. Concepto de entropía molar estándar.
Y también:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
En la reacción del agua, aunque disminuya el numero de moles, ¿no se produce a la vez una mezcla de dos gases y aumenta el desorden? No entiendo.
Tamara, 12 Años Antes
¡Hola Tamara! Ambos efectos son contrapuestos, pero el aumento del número de moles es siempre prioritario, por lo que es éste el que consideraremos en este caso y el desorden no aumenta, sino que disminuye. Además, en todo caso mirarías si se produce una mezcla de gases como productos, no en el caso de los reactivos.
QuimiTube, 12 Años Antes
Muy buena tu explicacion, puedes definir en terminos simples Entropia.
Gracias.
Joel, 11 Años Antes