Recuperar el brillo de la plata comparando oxidantes y reductores
Escrito por Quimitube el 3 enero
En la parte teórica del tema de oxidación-reducción, vimos en profundidad el concepto de potencial estándar de reducción para una semirreacción. Dicho potencial estándar nos indica la tendencia que presenta una especie a oxidarse frente al H+ o a reducirse frente al H2. Asimismo, podéis encontrar en nuestra web una tabla en PDF con los potenciales estándar de una serie de semirreacciones habituales:
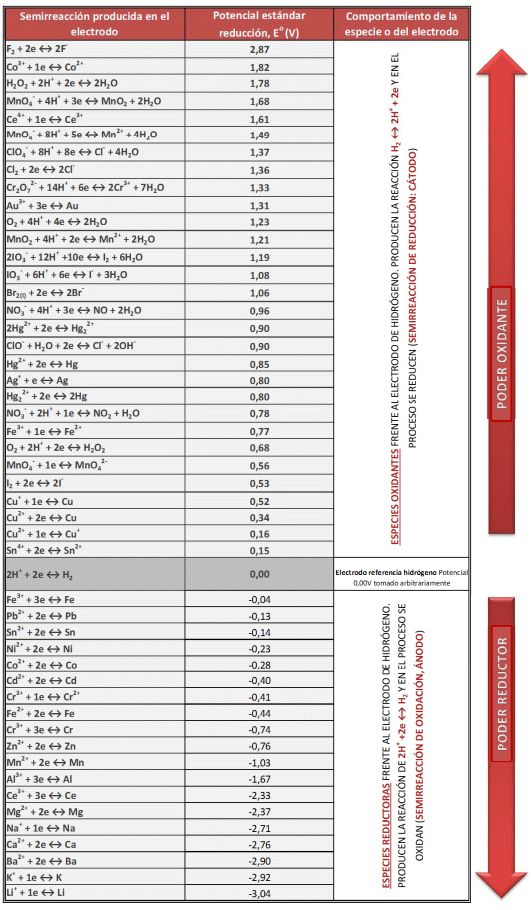
Pues bien, esta tabla nos permite determinar si una especie es más oxidante o más reductora que otra, en qué medida, y si una reacción química podrá o no tener lugar. Cuanto más arriba se encuentre una especie en la tabla de potenciales estándar, y por tanto cuanto mayor sea su potencial, mayor será su poder oxidante. Por el contrario, cuanto más abajo se encuentra en la tabla, y más pequeño (más negativo) sea su potencial, mayor será su poder reductor. Así, el oxidante más fuerte que aparece en esta tabla es el F2, con un potencial estándar de 2,87V. Este alto valor es consistente con la elevada electronegatividad del flúor y nos indica que el flúor tiene una mayor tendencia a aceptar electrones (es, efectivamente pues, un fuerte oxidante) que ningún otro elemento de la tabla periódica.
F2 (g) + 2e → 2F–(aq)
El más fuerte reductor que hallamos en la tabla indicada es el litio metálico, con un potencial estándar de -3,04V. Actuando como reductor, por tanto, la semirreacción sería:
Li(s) → Li+(aq) + 1e
Este hecho puede sorprender, ya que es el cesio, y no el litio, el elemento menos electronegativo de la tabla periódica. La anormalidad aparente se puede explicar por el hecho de que los potenciales estándar de electrodo son medidos en disolución, donde las interacciones intermoleculares son importantes, mientras que las propiedades periódicas como los potenciales de ionización y las afinidades electrónicas se miden en fase gaseosa. Debido a su pequeño tamaño, el catión Li+ es estabilizado en disolución acuosa por fuertes interacciones electrostáticas con la zona negativa del dipolo de las moléculas de agua. Estas interacciones resultan en un significativo aumento de la ΔHhidratación para el Li+ comparado con el Cs+, de modo que el litio metálico es el más potente reductor (más fácilmente oxidado) de todos los metales alcalinos (y de cualquier otro) en disolución acuosa, porque el producto de esta reacción, el catión litio, es termodinámicamente más estable aún que el catión cesio.
Como vemos, dado que las semirreacciones mostradas en la tabla aparecen ordenadas en función de sus potenciales estándar, podemos usar dicha tabla para predecir de forma rápida la fuerza relativa de varios oxidantes y reductores. Así, podemos utilizar la tabla para predecir si una reacción de oxidación reducción tendrá lugar espontáneamente o no, calculando el potencial estándar de la reacción como si de una pila se tratase, es decir, utilizando la fórmula:
¿Cómo recuperar el brillo de la plata deslustrada?
Esto que hemos comentado sobre la espontaneidad de las reacciones redox y la comparación de potenciales estándar, se puede emplear, por ejemplo, para estudiar el caso de una cubertería de plata que se cubre por un velo oscuro. Esta pátina oscura que se forma en la superficie del cubierto corresponde a sulfuro de plata, Ag2S. De esta forma, para revertir el proceso y lustrar de nuevo la plata, es necesario que se produzca el proceso siguiente:
Ag2S(s)+2e−→2Ag(s)+S2−(aq) E°=−0,71 V
Fotografía de Rob K636 en Flickr. Licencia CC By-NC-SA
Es decir, la reducción de la plata catiónica, Ag+, para dar nuevamente plata metálica, Ag0. Como vemos, este valor de potencial para la plata no coincide con el mostrado anteriormente en nuestra tabla porque las condiciones en uno y otro caso difieren significativamente. En este, lo que tenemos es la reducción de los cationes que se hallan formando sulfuro de plata sólido y no los cationes Ag+ en disolución acuosa. Puesto que esta semirreacción tiene un potencial estándar de -0,71V, necesitamos «enfrentarlo» a otra semirreacción que esté por debajo en la tabla de potenciales, es decir, que tenga un potencial estándar menor (más negativo) para lograr que la reacción se produzca y la plata metálica recupere su lustre inicial. ¿Habrá algún elemento de uso común y barato que nos permita este resultado?
Fotografía de Christian Frausto Bernal en Flickr. Licencia CC By-SA
Si observamos la siguiente tabla de potenciales, en la cual sí que podemos ver nuestra reacción de interés, la del Ag2S/Ag, en ese caso es posible predecir qué compuestos nos servirían para lustrar la plata de nuevo:
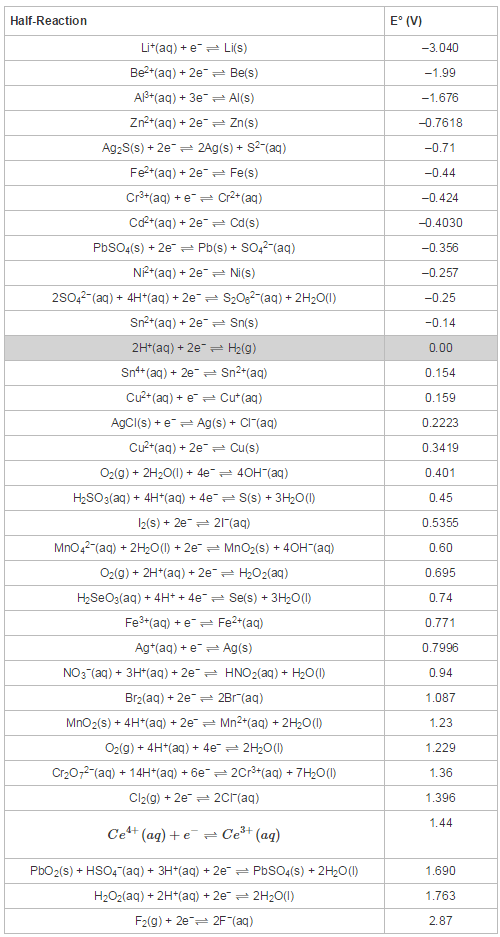
Tabla de potenciales estándar procedente de la chemwiki de UC Davis. «Comparing strenghts of oxidants and reductants«. Licencia CC BY-NC-SA
En el caso de esta tabla necesitamos buscar una semirreacción que esté por encima de la indicada, ya que los más negativos (reductores) están colocados en la parte superior de la tabla. Así, solo nos servirían para lustrar la plata los metales siguientes: litio, berilio, zinc y aluminio. Muchos productos que se venden como «milagrosos» para recuperar la plata no contienen más que zinc metálico, si bien vemos que en este caso será más efectivo utilizar aluminio metálico, que además es más barato y es más habitual en nuestros hogares. Así, la reacción que se produciría sería:
Semirreacción de reducción:
Ag2S(s)+2e−→2Ag(s)+S2−(aq) E°=−0,71 V
Semirreacción de oxidación:
Alo(s) → Al3+(aq) + 3e Eo = -1,67V
El potencial estándar global de la reacción será:
Eo = Eo sem.reducción – Eo sem.oxidación = -0,71 – (- 1,68) = +0,97V
El valor global de potencial estándar positivo nos indica que, efectivamente, esta reacción es espontánea (energía libre de Gibbs positiva).
Si cogemos un trozo de papel de aluminio y lo sumergimos en agua salada en contacto con el objeto de plata que deseamos limpiar, después de un tiempo basta sacar el objeto de plata y frotar con un trapito para que vuelva a lucir estupendo.
Como veis, la determinación de si una reacción química redox tendrá lugar o no a partir de los potenciales de reducción de las semirreacciones es realmente útil. Aquí tenéis otro ejemplo de una entrada de blog anterior, la predicción de qué ocurrirá si sumergimos una moneda de cobre dentro de una disolución de nitrato de plata.






