Contenido del Vídeo
Cuando tenemos un átomo polielectrónico, con dos o más electrones, debemos saber cómo se colocan estos electrones en los distintos orbitales, es decir, conocer su estructura electrónica. Denominamos a esto configuración electrónica, y para establecer dicha configuración electrónica debemos seguir 3 reglas importantes:
1.- Los átomos neutros en estado fundamental tienen sus electrones en los orbitales de energía más bajas que estén disponibles. Así, los orbitales se llenan según sus energías relativas, de menor a mayor.
2.- En cada orbital sólo puede haber 2 electrones. Los números cuánticos n, l y m de estos electrones coincidirán, mientras que se diferenciarán en su número cuántico de espín, s, uno tendrá un valor de 1/2 y otro de -1/2. Cuando los electrones ocupan el mismo orbital se dice que están apareados o que tienen espines antiparalelos.
3.- La regla de máxima multiplicidad de Hund establece que, para los átomos en estado fundamental, al llenarse los orbitales de energía equivalente (orbitales degenerados), por ejemplo, los 3 orbitales p, los espines de los electrones se mantienen desapareados o paralelos, si es posible.
Para establecer la configuración electrónica de un átomo, que es la representación de la distribución de los electrones en los diferentes orbitales del átomo, usaremos el siguiente diagrama de construcción general (diagrama de Moeller):
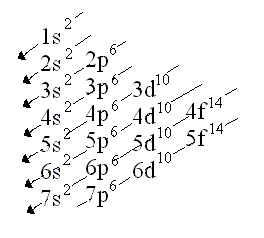
Category: Estructura de la materia y Propiedades periódicas de los elementos químicos.
Etiquetas: Configuración electrónica y Modelos atómicos.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola de nuevo: tengo dos duda si me haces el favor, una de ellas es en el min. 2:20 en el que dices «un electrón cuya última capa tiene 5 electrones»…. no lo entiendo. El segundo en el min. 2:30, ¿sería posible que hubiera en las cuatro cajitas que tienes en la pizarra esta configuración; en la primera 2, como los tienes puestos y en los otros tres orbitales dos de ellos con spin 1/2 y otro con spin -1/2?.
Muchas gracias.
Gonbla1998, 13 Años Antes
si sale
jhoan, 11 Años Antes
¡Hola de nuevo! 😀
En el minuto 2:20 no hay nada que entender jejeje, me he equivocado, sería «un átomo cuya última capa tiene 5 electrones» y no «un electrón». En cuanto a lo del minuto 2:30, los electrones, aunque estén en orbitales distintos, suelen escribirse de este modo, todos orientados en el mismo sentido, es decir, con el mismo spin.
Quimitube, 13 Años Antes
jaajjajaja, me lo imaginaba. jajajajjaaj. Sobre lo de spin, gracias, te lo agradezco.
Un saludo.
Gonbla1998, 13 Años Antes
profe xfa pudiera ud aclararme un poco mas sobre la configuracion del escandio cuando dice 2p6 no entendi esa parte
Miguel, 13 Años Antes
Hola Miguel, bienvenido. Lo que ocurre es que los orbitales p siempre son 3, el px, el py, y el pz. Como en cada orbital atómico caben 2 electrones, en total en los 3 p juntos cabrán 6. Así, en el nivel 2p, tendrás 6 electrones, y por eso ponemos 2p6.
QuimiTube, 13 Años Antes
profe tengo una duda en el 5:40 se va llenando separadamente cada orbital, y por eso el orbital P queda el 2pz sin nada? gracias 🙂
luis, 12 Años Antes
Hola Luis, exacto. Disculpa la tardanza, a veces se me pasan los comentarios, soy torpe 🙂 Un saludo
QuimiTube, 12 Años Antes
No entiendo como en en el minuto 6:42 el ultimo periodo es 3, en mi tabla periodica (que es de Gil Chaverri) dice que el periodo 3 no llega mas alla de Ar y que Sc esta en periodo 4 subnivel s. Este un error de la tabla de gil? Una particularidad? tu te equivocaste? que sucede?
Kuromi, 12 Años Antes
¡Hola! Sí, está bien la tabla periódica y también lo que yo he escrito, fíjate que aparece el 4s2 en la configuración electrónica que hemos indicado en el vídeo, sólo que siguiendo el diagrama de Moeller aparece antes 4s2 que 3d1.
QuimiTube, 12 Años Antes
Hola, Amiga Quiero Hacerte Una Pregunta, Es Que Tengo Un Proyecto De Ciencia de los materiales y la verdad tengo algunos vacios sobre la parte basica de los enlaces y quiero conocer como puedo sacar la valencia de un elemento a partir de su configuracion electronica, gracias a este video ya conosco como sacar la configuracion electronica a partir de su numero atomico, y sé que el(los) electrones de valencia son los electrones de la ultima capa, pero en si que son las capas ??
Estoy un poquito perdido agradezco tu colaboracion
y Muchas gracias por todo el material que brindas !
Camilo, 12 Años Antes
HOLA desde colombia. Muy buenos tus vídeos. Tengo una pregunta: ¿ porque los elementos de alto numero atómico no siguen los reglamentación de las capas cuánticas tradicionales? Hiciste referencia a esto en el final del video, mencionaste a los metales de transición, una breve explicacion seria de mucha ayuda. Muchas Gracias
David Cañas, 12 Años Antes
Hola David, en los metales de transición los orbitales d son bastante especiales, de hecho son estos los que confieren sus propiedades a dichos metales. Se ha determinado por cálculos o de forma experimental que hay una inversión en ellos. Un saludo.
QuimiTube, 12 Años Antes
Per favor necesito que me alluden a hacer una configuracion electrónica de los elementos quiero aprender
Sebastian, 11 Años Antes
Hola, te recomiendo ver este vídeo en el que comentas, ahí estará mejor explicado que si te lo explicamos por escrito. Un saludo.
QuimiTube, 11 Años Antes
Mi hijo necesitaba saber configuración electrónica. Miro el vídeo y le quedo claro. Gracias.
Félix, 11 Años Antes
Hola Félix, me alegra mucho que le sirviera. Un saludo.
QuimiTube, 11 Años Antes
Hola, disculpe no entendí muy bien cómo se simplifica o cómo logro una configuración simplificada. (vease en el minuto 7:00)
Francisco, 11 Años Antes
¡Hola! Supón que quieres escribir la configuración simplificada del sodio. Su configuración completa (porque tiene 11 electrones) es [Na]: 1s2 2s2 2p6 3s1. Si te fijas en esta configuración, todo lo que hay antes de la última capa, antes de 3s1, se corresponde a la configuración electrónica del neón, gas noble con 10 electrones y configuración electrónica [Ne]: 1s2 2s2 2p6. Así, podrías sustituir todo esto en la configuración del sodio poniendo:
[Na]: [Ne] 3s1
Fíjate que donde había 1s2 2s2 2p6 hemos puesto [N3] porque son equivalentes.
Un saludo
QuimiTube, 11 Años Antes
Hola como se simplifica
jose de jesus, 11 Años Antes
¡Hola! Cuando tienes la configuración electrónica, puedes coger el kernel (todo lo que no es la última capa) y sustituirlo por el símbolo del gas noble del período anterior entre corchetes. Por ejemplo, el sodio:
Na: 1s2 2s2 2p6 3s1
El kernel es todo excepto la última capa, 3s1, es decir, 1s2 2s2 2p6.
El gas noble inmediatamente anterior es el neón, así que ponemos:
Na: [Ne] 1s1
Fíjate que hemos sustituido 1s2 2s2 2p6 por [Ne]
QuimiTube, 11 Años Antes
hola me pueden xfa decir cual es la configuracion electrónica del grupo 7 a de la tabla periódica
juan trejos, 11 Años Antes
Hola Juan, cada átomo tiene su propia configuración electrónica y en el grupo 7 tienes muchos elementos. Ahora bien, por ser del mismo grupo sí que compartirán la estructura de su última capa. Por ejemplo, mira la configuración del manganeso: http://es.wikipedia.org/wiki/Manganeso
Los otros dos elementos del grupo 7 son tecnecio y renio y verás que sus configuraciones son similares:
http://es.wikipedia.org/wiki/Tecnecio
http://es.wikipedia.org/wiki/Renio
Todos ellos acaban como d5s2.
QuimiTube, 11 Años Antes
no entiendo por que no sale 7d 6f y 7f yo sinpre trabaje con estos 3 faltantes y primera ves que veo esto
braulio, 11 Años Antes
Hola Braulio, teóricamente podríamos seguir mucho más allá, pero no te preocupes, realmente muchas veces verás que están omitidos porque las configuraciones electrónicas de los átomos más habituales no necesitan llegar a estos orbitales porque tienen muchos menos electrones. Un saludo.
QuimiTube, 11 Años Antes
PROFE, POR FAVOR ME PODRIA DECIR A A QUE ELEMENTO QUIMICO PERTENECE ESTA DISTRIBUCION ELECTRONICA
1S2 2S2 2P6 3S2 3P6 4S1MIL GRACIAS
GLADYS PALACIO, 11 Años Antes
Hola Gladys, si sumas los electrones tendrás el número atómico del elemento y lo puedes mirar en la tabla periódica: 2+2+6+2+6+1.
QuimiTube, 11 Años Antes
Como saco la valencia es para un examen
Kevin Alonso Delira Lara, 10 Años Antes
Hola Kevin, mira lo del número de oxidación que es similar:
http://www.quimitube.com/videos/definicion-numero-oxidacion
http://www.quimitube.com/teoria-redox/normas-determinacion-numero-oxidacion
QuimiTube, 10 Años Antes
y para la configuración electrónica de iones positivos y negativos, y la del cation como?
KAREN, 10 Años Antes
Hola Karen, si tienes un anión, debes sumar tanto electrones como cargas negativas tenga, y hacer la configuración con ese número de electrones. Por ejemplo, el cloro tiene 17 electrones, pero si tienes el anión cloruro, Cl-, no tendrá 17 sino 18, y debes hacer su configuración con 18 electrones.
Para el caso de los cationes es al contrario, restando. Por ejemplo el sodio tiene 11 electrones, pero si tienes el catión sodio, Na+, entonces no tendrá 11 sino 10, y tienes que hacer la configuración electrónica con 10 electrones.
QuimiTube, 10 Años Antes
Hola, quisiera saber si todos los metales de transición tienen 2 electrones de valencia por lo general, me refiero a que si los electrones de los subniveles d(difuso) y f(fundamental) no se cuentan como electrones de valencia, por ejemplo:
Vanadio: [Ar] 3d3 4s2; solo cuento como electrones de valencia los dos electrones que se encuentran en el nivel 4, o los 5 electrones del nivel 3 y 4, ya que si estos 5 electrones se pierden su configuración electrónica seria similar a la del gas noble y seria mas estable.
Gracias de antemano.
Rodrigo Alfaro, 10 Años Antes
ojala que me baya bn y que Dios les bendiga
jhoana, 10 Años Antes
¡Mucha suerte!
QuimiTube, 10 Años Antes
oyo en verdad no entiendo nada…..las configuraciones electronicas son todas completamentes distintas?
daynelly reyes, 10 Años Antes
Son propias de cada elemento. Ten en cuenta que la configuración electrónica depende del número total de electrones, y esto cambia con el elemento. Por ejemplo un átomo de sodio tiene 11 electrones y uno de cloro 17, es lógico que tengan configuraciones distintas. Un saludo.
QuimiTube, 10 Años Antes
uy gracias esto me servio bastante xq mi profe no sabe nada y nos desvia pero esto me ayudo gracias 🙂
BRENDA, 10 Años Antes
Muchísimas gracias por todos tus videos. A mi y a mis compañeros de clase nos están siendo de gran ayuda, y además explicas muy bien (: Si aprobamos va a ser gracias a ti vamos! Espero que tus videos nos ayuden durante todo el año (: Muchísimas gracias!
Marni, 10 Años Antes
¡Muchísimas gracias y mucho ánimo!
QuimiTube, 5 Años Antes
hola como hago cuando el numero se pasa del numero que quiero
benjamin, 10 Años Antes
¡Hola! Pones menos electrones en el último nivel hasta llegar al número que quieres y sin pasarte.
QuimiTube, 5 Años Antes
profesora una pregunta porque la ubicacion de los elementos depende de la configuracion de los electrones
pilar, 9 Años Antes
Hola Pilar, porque están colocados en orden creciente de número atómico, es decir, del número de protones en el núcleo. Pero como en un átomo neutro el número de protones y electrones es el mismo, su configuración electrónica también depende del número atómico y por tanto su colocación en la tabla periódica.
QuimiTube, 9 Años Antes
Que es un atomo poli electrónico
Michel, 8 Años Antes
¡Hola! Un átomo con más de un electrón, generalmente muchos de ellos.
QuimiTube, 5 Años Antes
oh muchas gracias es lo mismo que vi el mismo dia que me dieron esta clase 🙂
Andres, 8 Años Antes
hola excelente video tengo una duda ¿como se escribe la configuración para elementos con mas de 118 electrones ?
hugo salazar, 7 Años Antes
¡Hola! En ese caso seguiríamos la secuencia del diagrama de Moeller siempre teniendo en cuenta los cuatro tipos de orbitales existentes y cuántos caben en cada uno de ellos.
QuimiTube, 5 Años Antes