Contenido del Vídeo
En el siguiente ejercicio vamos a determinar la solubilidad de dos sólidos de naturaleza muy distinta, como son el yodo y el cloruro potásico, en dos disolventes también de naturaleza muy distinta, el agua y el tetracloruro de carbono. En concreto, el enunciado completo es:
¿En qué disolvente serán solubles los compuestos yodo y cloruro potásico? ¿En agua o en tetracloruro de carbono?
Para determinar la solubilidad vamos a recurrir a la siguiente regla nmemotécnica: «Semejante disuelve a semejante«. Esto significa que:
– Los disolventes polares disuelven bien a los solutos polares o cargados (iónicos).
– Los disolventes apolares disuelven bien a los solutos apolares.
Así, lo que debemos hacer en primer lugar debemos determinar el tipo de enlace o de fuerzas intermoleculares que mantienen unidos entre sí los distintos compuestos, tanto solutos como disolventes:
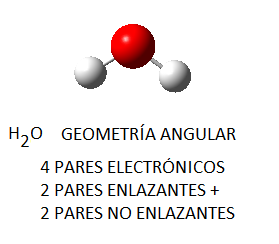
– Agua. Como hemos visto reiteradamente, el agua es una molécula de geometría angular, con enlaces polares, que es globalmente polar (los dipolos de sus enlaces H-O no se anulan por geometría) por lo que forma dipolos permanentes que se unen entre ellos por enlaces de hidrógeno. POLAR.
– Tetracloruro de carbono, CCl4. Aunque los enlaces C-Cl serán polares, ya que el cloro es más electronegativo que el carbono, la molécula tendrá una geometría tetraédrica (un átomo central rodeado de cuatro pares enlazantes), y los momentos dipolares de los cuatro enlaces se anularán entre sí, por lo que se trata de una molécula globalmente apolar por geometría. APOLAR.
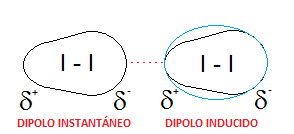
– Yodo. También hemos visto en múltiples ejercicios previos el caso del yodo, que está formado por moléculas diatómicas de I2, totalmente apolares, ya que se trata de dos átomos idénticos. Esto hará que las únicas fuerzas intermoleculares que se puedan dar entre distintas moléculas de yodo sean dipolo instantáneo-dipolo inducido, es decir, fuerzas de dispersión o de London. APOLAR.
– Cloruro potásico. Puesto que está formado por la unión de un elemento muy electronegativo, el cloro, y de un elemento muy poco electronegativo, el potasio, esta unión dará lugar a un compuesto iónico, formado por cationes K+ y por aniones Cl-. Es, por tanto, una red cristalina formada por IONES (especies cargadas).
Una vez establecida dicha clasificación se puede deducir fácilmente, tal y como se explica en el tutorial, que el yodo será soluble en tetracloruro de carbono y no en agua, mientras que, por el contrario, el cloruro potásico será soluble en agua y no en tetracloruro de carbono.
También te puede interesar:
Cambios físicos: fundir cloruro potásico, hervir agua y disolver yodo en benceno
Propiedades físicas del cobre, el dióxido de carbono y el fluoruro de cesio
Razonar ciertos hechos experimentales, Cl2 y KCl, NaF y F2, Ag y AgCl
Propiedades de las redes cristalinas BaCl2, H2O, Diamante e I2
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Enlace covalente, Enlace iónico y Fuerzas intermoleculares.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Muy buena información! muy lógica y fácil de entender, además del video que termina de aclarar toda duda. Gracias!
Francisco Chaves, 12 Años Antes
Muchas gracias Francisco y bienvenido, me alegra que te sirva. Un saludo.
QuimiTube, 12 Años Antes
¿Porque el yodo siendo apolar como se afirma anteriormente no es tan soluble en ciclohexano que tambien es apolar?. y si el hexano, apolar y el etanol polar,porque son miscibles entre ellos?
Sandra Catalina, 10 Años Antes
¡Hola Sandra! No conozco con exactitud la solubilidad de estos compuestos, aunque en el caso del yodo, cuando dices que no es tan soluble en ciclohexano, ¿te refieres con respecto al hexano? ¿O con respecto a otro compuesto?
En cuanto a la miscibilidad del hexano y el etanol es frecuente que líquidos con distinta polaridad se puedan disolver parcialmente en determinadas proporciones, especialmente si el compuesto polar presenta una parte más apolar como ocurre con el etanol. De hecho, el etanol es una sustancia que en distintas proporciones se puede mezclar con algunos disolventes apolares.
QuimiTube, 10 Años Antes
MUCHAS GRACIAAAAS ! te mando un abrazo de gol
marcos, 9 Años Antes
Muchas gracias 🙂 Un saludo grande
QuimiTube, 9 Años Antes
Disculpa como separo yodo de kCl en solución
Alan Jafet, 9 Años Antes
Hola, basándote en su distinta solubilidad podrías por ejemplo mezclar tu disolución con CCl4 y el yodo molecular pasaría a este disolvente, mientras que el KCl quedaría en el agua.
QuimiTube, 9 Años Antes
explique por qué el I2 es soluble en CCl4
IRALIS, 5 Años Antes
Hola Iralis, te sugiero ver el vídeo, es lo que explicamos en él. Un saludo.
QuimiTube, 5 Años Antes