Contenido del Vídeo
En este ejercicio de enlace químico vamos a estudiar las propiedades de una serie de redes cristalinas a una temperatura de 0ºC. El enunciado es:
A la temperatura de 0ºC, el cloruro de bario, el agua, el diamante y el yodo son sólidos, pero la naturaleza de sus redes cristalinas es muy distinta. ¿Qué tipos de redes forma cada uno de ellos?
Para determinar el tipo de enlace que se da entre los átomos de estos compuestos y a partir de esto el tipo de fuerzas intermoleculares debemos, como siempre, observar la diferencia de electronegatividad.
– Cloruro de bario. Se tratará de un compuesto iónico, ya que la diferencia de electronegatividad entre el bario y el cloro es mayor de 1,7. Así, tendremos una red cristalina formada por iones bario, Ba(2+), e iones cloruro, Cl-, en forma totalmente ordenada.
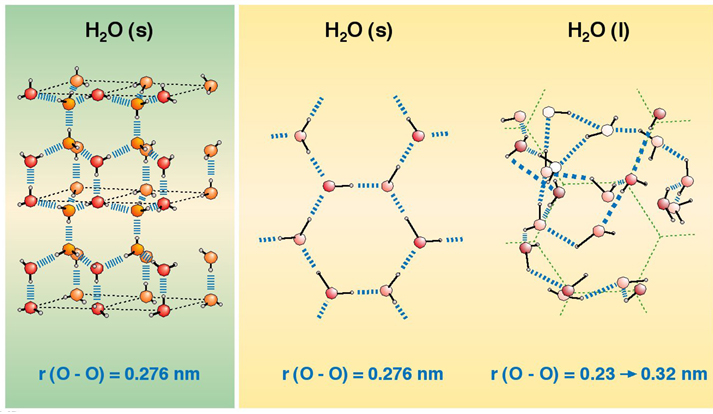
– Hielo. A 0ºC el agua es un sólido, el hielo. Se trata, como hemos visto reiteradamente, de una sustancia covalente polar, ya que la diferencia de electronegatividad del oxígeno y el hidrógeno es de 1,4, y esto hace que los enlaces sean muy polares. Además, dado que la geometría de la molécula de agua es angular, se tratará de una molécula globalmente muy polar porque los momentos dipolares de ambos enlaces H-O no se anulan por geometría. Esto hace que las moléculas de agua se unan entre sí por enlaces de hidrógeno, de forma ordenada y cristalina.
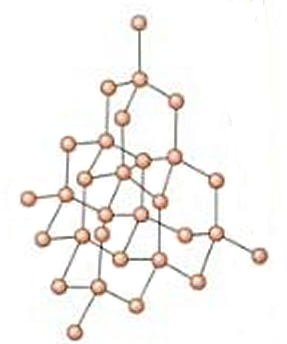
– Diamante. Se trata de una red covalente pura, formada únicamente por átomos de carbono. Se unirán, por tanto, a través de enlaces covalentes. En el diamante los carbonos presentan hibridación sp3, de forma que la disposición de los 4 pares electrónicos enlazantes en torno a cada carbono es tetraédrica. Así ocurre de forma sucesiva. Los enlaces covalentes son enlaces muy fuertes, y esto hace que el compuesto presente una gran dureza.
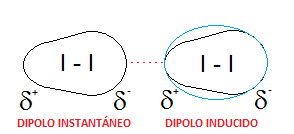
– Yodo. Hemos visto también en múltiples ejercicios previos el caso del yodo, que está formado por moléculas diatómicas de I2, totalmente apolares, ya que se trata de dos átomos idénticos. Esto hará que las únicas fuerzas intermoleculares que se puedan dar entre distintas moléculas de yodo sean dipolo instantáneo-dipolo inducido, es decir, fuerzas de dispersión o de London.
Cambios físicos: fundir cloruro potásico, hervir agua y disolver yodo en benceno
Propiedades físicas del cobre, el dióxido de carbono y el fluoruro de cesio
Razonar ciertos hechos experimentales, Cl2 y KCl, NaF y F2, Ag y AgCl
Solubilidad de yodo y cloruro potásico en agua y tetracloruro de carbono
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Enlace covalente, Enlace iónico y Fuerzas intermoleculares.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Muy buena explicación
jose, 5 Años Antes
¡Gracias!
QuimiTube, 5 Años Antes