Contenido del Vídeo
El etino o acetileno es el alquino (hidrocarburos con triple enlace carbono-carbono) más sencillo. Su estructura de Lewis es:
![]()
Se sabe experimentalmente que es una molécula lineal.
Del mismo modo que vimos en el Modelo del Enlace de Valencia para la molécula de nitrógeno, N2, la existencia de un triple enlace implica un enlace de solapamiento frontal, de tipo sigma, σ, y dos enlaces de solapamiento lateral, de tipo pi, π. Es decir, el enlace triple carbono-carbono estará formado por:
- Un enlace de tipo σ entre un orbital híbrido sp de un carbono y un orbital híbrido sp del otro carbono, con solapamiento frontal.
- Dos enlaces de tipo π entre los orbitales py y pz de cada uno de los carbonos, con solapamiento lateral.
Por tanto, para poder formar dos enlaces π, cada átomo de carbono del etino requerirá 2 orbitales atómicos p sin hibridar, que puedan formar enlace múltiple. Es por este motivo que los carbonos que presentan triple enlace tendrán 2 orbitales p que no se modifican, y sólo se hibridarán, por tanto, el orbital 2s y uno de los orbitales 2p. Así, el etino y todos los compuestos con triple enlace carbono-carbono, tendrán hibridación sp, lineal.
Recordemos primero que, para que el carbono forme 4 enlaces covalentes, debe hallarse en estado excitado. Un electrón del orbital 2s de la configuración electrónica del estado fundamental debe promocionar al orbital 2p vacío:
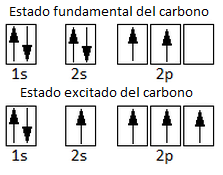
Ahora, como hemos dicho, únicamente se hibridan el orbital 2s y el 2p, porque deben quedar 2 orbitales p puros, con los que formar el enlace múltiple:
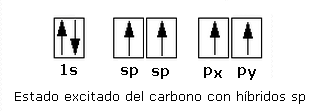
Los orbitales híbridos sp se disponen de forma lineal, formando 180º entre sí. Los orbitales p sin hibridar quedan perpendiculares a los ejes de los híbridos. Así, la geometría del etino se podrá dibujar como:
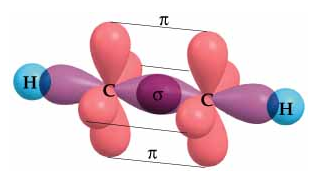
El enlace triple es aún más fuerte que el enlace doble, y la distancia C-C es menor. Así, la longitud del enlace simple C-C es de 0,154 nm, la del doble, 0,134 nm y la del triple, 0,120 nm.
Si bien el enlace triple, como el doble, es rígido, como únicamente tiene 1 sustituyente cada carbono no da lugar a isomería geométrica.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente, Geometría molecular e hibridación y Modelo enlace de valencia.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Espero que vuestros vídeos me ayuden, de momento, las explicaciones me resultan muy útiles!
Tenéis algo de termodinámica? Gracias!
Conso, 13 Años Antes
Hola Conso, bienvenida 🙂 Por ahora no tenemos termodinámica, aunque es el tema que toca desarrollar después de enlace químico según el índice que tenemos establecido. No sé decirte cuándo tendremos algo, quizá aún tarde algún tiempo… No obstante puedes preguntarnos las dudas que tengas. Un saludo grande.
QuimiTube, 13 Años Antes
Hola, soy alumna de bachillerato, tus vídeos son geniales, me resuelven muchas dudas y haces facilmente comprensible lo que explicas, seguiré viéndolos. Me pondré en contacto contigo si me surge alguna duda. Muchas gracias por tu tiempo. Un saludo
Alumna, 13 Años Antes
¡Hola! Me alegro mucho de que te sirvan, a ver si pronto puedo tener completo el temario completo de segundo para que no falte nada 🙂 Y gracias por continuar viéndolos. Por supuesto, si te surgen dudas intentaré ayudarte a despejarlas. Un saludo enorme.
QuimiTube, 13 Años Antes
Hola ! Sigo agradeciéndote estos videos, me van a salvar este año ! Tienes alguno explicando termodinámica ? Definitivamente no la entiendo.. Un abrazo 🙂
Blanca, 13 Años Antes
¡Hola! Gracias de nuevo 🙂 Lo siento mucho con termodinámica, sé que muchos estáis en ese tema, pero todavía tardarán en llegar yo calculo que como mínimo un mes porque no me es posible grabarlos antes. De todos modos me puedes preguntar todas las dudas, de termodinámica también, aunque no estén los vídeos. ¡Mucha suerte!
Quimitube, 13 Años Antes
buenas explicaciones… gracias 🙂
Luis, 12 Años Antes
Gracias Luis por comentar 🙂 Un saludo
QuimiTube, 12 Años Antes
tus videos son geniales graciias m ayudan en todoo …sigue asi y felicitaciones….asi k cualkier duda …tndre presnt tus videoss..:)
Evelyn, 12 Años Antes
Muchísimas gracias por tu comentario Evelyn, me alegro muchísimo de que te sirvan y por supuesto intentaré resolver tus dudas. Un saludo grande.
QuimiTube, 12 Años Antes
los orbitales 2p que quedan libres, que forman el enlace Pi ,son px y py pero en el gráfico ( dibujo) pareciera que son px y pz importa esto, o no..
fernando, 12 Años Antes
¡Hola Fernando! No tiene importancia, no podemos realmente saber qué orbitales p se hibridan porque los ejes que establecemos son ficticios o simplemente es una referencia que tomamos para poder dibujarlo.
QuimiTube, 12 Años Antes
Excelente tu informacion . Una duda que tipos de enlace pueden formar enlate triple con hibridacion Sp ?
Angela, 12 Años Antes
¡Hola! Si te refieres al carbono, puedes encontrar carbonos con un enlace triple y uno simple, o carbonos con dos enlaces dobles.
QuimiTube, 12 Años Antes
Hola! bueno antes que nada, explicas excelente. muy claro y al ritmo justo, ni muy rápido ni muy lento. y con mucha claridad y buena entoncación, la verdad me están resultando muy útiles tus videos. muchísimas gracias, estoy agradecida de haberlos encontrado.
Tengo una gran duda que no puedo resolver.. revisé tres libros, internet en español y en inglés y aún así no logro entender: HIBRIDACiÓN para el N2O. sé que es una molécula lineal, que la Lewis es [N triple enlace N enlace simple O] pero no veo cómo es que se logran esos enlaces por hibridación.
carolina, 11 Años Antes
¡Hola Carolina! Agradezco mucho tu comentario, a veces algunas personas piensan que voy muy deprisa y otras demasiado lento, así que es complicado «llover» al gusto de todos en esto.
En cuanto a la hibridación, si el nitrógeno es el átomo central, con un triple enlace y un enlace simple, entonces tendrás hibridación sp como en el caso del carbono del etino:
http://www.quimitube.com/videos/hibridacion-sp-con-enlaces-triples-carbono-carbono-etino-o-acetileno/
Es decir, el orbital s y un orbital p se hibridan para formar dos enlaces híbridos sp, dispuestos de forma lineal, que se enlazan uno de ellos con el otro nitógeno y otro con el oxígeno. Los orbitales p que quedan sin hibridar formarán el enlace triple.
Espero que te sirva esta respuesta.
Un saludo.
QuimiTube, 11 Años Antes
gracias por facilitar toda esta información y quitarme tantas dudas de este tema y todo esto explicado de forma clara y sencilla, de verdad gracias
R, 11 Años Antes
Muchas gracias a ti por comentarlo, los comentarios dan vida a la página. Un gran saludo.
QuimiTube, 11 Años Antes
Eres hermosa en todos los aspectos xd gracias por tus videos ; tienes cuenta de facebook o skype ? Me gustaría conocerte, soy estudiante de matemáticas pero nos dan clases de química porque mi u maneja tronco común
Sebastian rodriguez, 10 Años Antes
Hola Sebastián, gracias por tu comentario. Tenemos el facebook de quimitube, http://www.facebook.com/quimitube. Un saludo grande y suerte con la química.
QuimiTube, 10 Años Antes
Hola, muchas gracias por tus videos, me son realmente útiles. Mi duda es que decimos que en el enlace triple hay un enlace sigma y dos pi. Pero en la gráfica marcamos dos enlaces sigma: el sp-sp y el sp-s. ¿Como es eso?¿Debo tener en cuenta nomas el que se forma entre ambos carbonos? Gracias y saludos.
Lucía Torre, 10 Años Antes
Hola Lucía, los enlaces sigma sp-s son entre el carbono y el hidrógeno, pero para considerar el enlace triple efectivamente solo tenemos en cuenta el formado entre ambos carbonos, un sigma sp-sp, y dos enlaces pi.
QuimiTube, 10 Años Antes
Hola, hay un error, un orbital s se combina con un Px y no queda un orbital px y py sino py y pz
Nico, 10 Años Antes
Hola Nico, no es un error, la denominación de los orbitales es algo relativo, depende de cómo coloques los ejes en tu imaginación. Esos ejes no están ahí en realidad ni los orbitales de un átomo están rotulados con un nombre, solo es como nosotros pensemos nombrarlos para poder representar y entender la molécula. Por tanto, esto es totalmente indiferente para entender la estructura final del etino. Un saludo.
QuimiTube, 10 Años Antes
Hola, primero de todo, muchas gracias por tus videos, me han ayudado mucho.
Pero tengo una pregunta, y es que no entiendo por qué tienen que quedar 2 orbitales sin hibridarse
Gracias de antemano
Raul, 10 Años Antes
Hola Raúl, cuando un carbono forma un triple enlace, necesita necesariamente 2 orbitales p con la disposición que ves en el dibujo, que solaparán de forma paralela. Es decir, en todo enlace triple tenemos que tener entre ambos carbonos 1 enlace sigma (que es el que llevan a cabo los orbitales híbridos sp) y 2 enlaces pi (que solo pueden llevar a cabo orbitales p sin hibridar). Esto se ha postulado así porque es congruente con la geometría del etino, que es lineal.
QuimiTube, 10 Años Antes
Buenas quería darte las gracias por todos los vídeos que has subido en estos años, ayudan a muchísima gente!
A más de uno nos gustaría tenerte en clase se entendería todo mejor jaja
Mucho ánimo y de verdad, muchas gracias!!
Alejandra, 10 Años Antes
¡Muchas gracias por tu comentario! Me alegra que sirvan tanto 🙂 Un abrazo.
QuimiTube, 9 Años Antes
Excelentes videos y explicacón desde Argentina, estudiando Biología el martes rindo un final super importante. Gracias!
Santiago, 10 Años Antes
Me alegra mucho que te sirvan, un saludo grande.
QuimiTube, 9 Años Antes
hola, no tuve tiempo de ver el video así que solo leí rápido el texto. Mi duda es ¿Donde quedan los electrones en el enlace doble y triple?, ¿En los hibridos o puros? …
Lucero, 9 Años Antes
¡Hola! Uno de los enlaces, el simple, está formado por orbitales híbridos, mientras que los dobles y triples siempre quedan en paralelo en orbitales p sin hibridar.
QuimiTube, 5 Años Antes
¿Que es un zupentino? Gracias
Tulio, 5 Años Antes
me pueden decir por favor entonces ¿Qué tipo de hibridación adopta el carbono para formar dicha molécula?
Saray, 5 Años Antes
¡Hola! Lo tienes en el propio título, en el etino la hibridación es sp.
QuimiTube, 5 Años Antes
Buenas tardes, muchas gracias por lo que haces. Tengo una duda, ¿cual es finalmente la geometría molecular? ¿Lineal?
Marina, 5 Años Antes
¡Hola Marina! ¡Gracias! Sí, el etino tiene geometría lineal. Un saludo.
QuimiTube, 5 Años Antes