Contenido del Vídeo
Para explicar la hibridación sp3 tomaremos como ejemplo diversas moléculas; en este primer vídeo nos centraremos, en concreto, en la hibridación sp3 del átomo de carbono en los alcanos sencillos como metano (CH4) y etano (CH3CH3).
Hibridación sp3 para la molécula de metano, CH4
Según datos experimentales, la molécula de metano, CH4, es apolar y presenta geometría tetraédrica (ángulos de 109,5º), formando 4 enlaces C-H que son idénticos entre sí. Ya hemos predicho, además, dicha geometría mediante el Modelo de Repulsión de pares electrónicos de la capa de valencia, RPECV, pero si estudiamos el enlace en mayor profundidad, para explicar que los cuatro enlaces C-H sean idénticos, debemos recurrir a la hibridación de orbitales atómicos.
Consideremos en primer lugar la configuración electrónica del carbono:
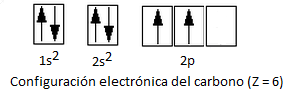
Según esta configuración, el compuesto que el C y el H deberían formar sería de estequiometría CH2 y no CH4, ya que el carbono únicamente presenta dos orbitales semiocupados que pueden formar enlace covalente. Como en el caso de la hibridación sp del cloruro de berilio, BeCl2, y de la hibridación sp2 del trifluoruro de boro, BF3, se acepta que un electrón del orbital 2s promociona al orbital 2p vacío. Es decir, el átomo de carbono pasa de un estado fundamental a un estado excitado, ya que el salto electrónico requiere un aporte de energía:
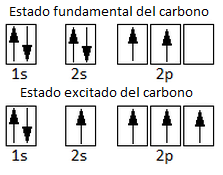
En estado excitado el carbono podrá formar 4 enlaces C-H, pues ya tiene 4 electrones desapareados. Sin embargo, estos 4 enlaces no serían equivalentes, porque estarían formados por orbitales distintos (1 orbital s y 3 orbitales p, y los 3 enlaces p forman entre sí un ángulo de 90º, son perpendiculares). ¿Cómo es, entonces, que los 4 enlaces C-H son iguales y forman un ángulo de 109,5º? Pues es posible porque los 4 orbitales atómicos se hibridan (se combinan) para dar 4 orbitales híbridos sp3.
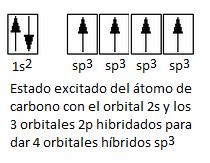
Se les llama híbridos sp3 porque proceden de la combinación de 1 orbital s y 3 orbitales p, por lo que tienen un 25% de contribución o de carácter de orbital s y un 75% de contribución o carácter de orbital p. Los 4 híbridos sp3 son equivalentes en forma y en energía, y se dirigen a los vértices de un hipotético tetraedro. Ahora estos 4 híbridos sp3 pueden solapar cada uno de ellos con el orbital 1s del átomo de hidrógeno, para dar los 4 enlaces sigma (σ) simples (solapamiento frontal). El ángulo de enlace del tetraedro es, en efecto, 109,5º, tal y como se determina de forma experimental para el carbono.
La geometría de la molécula de metano la podemos dibujar, por tanto:
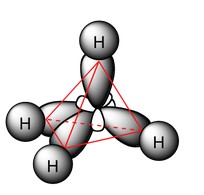
Molécula de metano procedente de https://chemwiki.ucdavis.edu
Hibridación sp3 para la molécula de etano, CH3CH3
En el caso de la molécula de etano, cada uno de los átomos de carbono presentará una hibridación sp3 y, como tal, los 4 híbridos sp3 formados se dirigirán hacia los vértices de un tetraedro. Por tanto, ambos átomos de carbono tendrán geometría tetraédrica, y se enlazarán entre sí con un enlace simple de tipo sigma, σ, que surge del solapamiento frontal entre dos orbitales sp3. Los restantes orbitales, 3 para cada carbono, forman enlace frontal sigma con los orbitales 1s de los hidrógeno. Así, la geometría del etano se puede representar como:
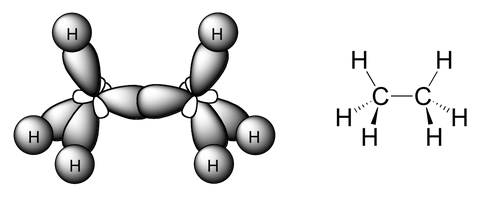
Molécula de etano procedente de https://chemwiki.ucdavis.edu
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente, Geometría molecular e hibridación y Modelo enlace de valencia.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola!
Donde puedo encontrar el video del enlace metalico?
Muchas gracias! Muy bien explicados todos los videos/clases!
🙂
dg, 11 Años Antes
¡Hola! Gracias 😀
El enlace metálico no lo he podido grabar todavía, llegará en próximas entregas junto al iónico jejeje
Quimitube, 11 Años Antes
Felicidades con el Videoblogg, por supuesto, lo primero que he hecho es votar esta magnifica «LOCURA» que habéis creado y desde aquí, tenéis todo mi apoyo.
Actualmente me encuentro estudiando química de 1º de Grado y la verdad que sin vosotr@s, no sé que hubiera hecho con esta otra «LOCURA» que para mi está siendo esta asignatura.
Felicidades, muchas felicidades y estar atent@s al Intermedio….
Pablo Rudi, 11 Años Antes
Muchísimas gracias Pablo y bienvenido, nos hace mucha ilusión el apoyo, especialmente si te están ayudando las clases en 1º de Grado 😀 ¡Y gracias por el voto!
En cuanto a lo del Intermedio (imagino que te refieres al programa televisivo), ¿qué va a salir? ¿Algo relacionado con la Química? ¿O vas a salir tú? Lo miraré con atención jejejeje
Un saludo enorme.
QuimiTube, 11 Años Antes
No tienes por qué dármelas, en realidad somos nosotros quienes estamos tremendamente agradecidos por gente como vostr@s que hacéis realidad la ilusión de aprender una materia como es la química.
Por otro lado, no sé si en estos comentarios se puede hablar de cualquier cosa o simplemente son para tratar la asignatura???, no quisiera estar llenando de líneas un espacio útil para el aprendizaje…perdona si es esto último!!!!
Y en cuanto al Intermedio…, vas bien encaminad@, ya están informados de vuestra web y…quien sabe, a lo mejor algún día deciden haceos una referencia. (pero esto último ya no depende de mi) SUERTE CON EL PREMIO
Rudsolpa, 11 Años Antes
Bueno, en teoría los comentarios son para hablar sobre las dudas del vídeo, pero no hay problema porque hagamos una excepción jeje. Lo cierto es que tenemos ahora mismo un problema para quien quiere dejar un comentario no relativo a un tema concreto, por lo que estamos desarrollando un foro que verá la luz dentro de poco (espero); así podríamos hablar de química, o de cualquier otra cosa 😀
Y lo del Intermedio es genial jajaja, mira que si nos mencionan un día de estos y sale mi cara en la tele… ¡Qué vergüenza! 😀 Aunque desde luego supondría un impulso increíble para nuestro proyecto.
Un saludo enorme,
Carmen
QuimiTube, 11 Años Antes
Hola! Me ha servido de mucha ayuda el video, ya que estudio por libre y me cuesta bastante! Muchas gracias!! ¿hay algun video que explique sobre los alcanos ramificados? Me hago un lio a la hora de nombrarlos… Gracias otra vez! 🙂
Nikaly, 11 Años Antes
¡Hola! Gracias de nuevo por comentar, los comentarios dan vida a la página 🙂 Me alegro de que te haya servido este vídeo. De alcanos y formulación orgánica no tenemos nada todavía, pero puedes preguntar tus dudas si quieres. Mucha suerte, eso de estudiar por libre no es nada fácil. Un saludo.
QuimiTube, 11 Años Antes
Felicitaciones!!!!!!!!!!! Muy buena explicación
claudio, 11 Años Antes
Muchas gracias Claudio y bienvenido 🙂
QuimiTube, 11 Años Antes
por favor sube mas temas ,
aldo, 10 Años Antes
Hola, soy estudiante del primer ciclo de la UNALM (Perú) y sus videos me ayudan a comprender mejor los temas de Química General
MUCHAS GRACIAS
Jorge luis, 10 Años Antes
Hola Jorge Luis, me alegro muchísimo de que te sirvan. Mucho ánimo con tus estudios y gracias por comentar.
QuimiTube, 10 Años Antes
Hola, hasta ahora vi que todas las hibridaciones son internas, o sea, entre orbitales de un mismo átomo, tal vez es una pregunta muy fuera de lugar, pero, ¿existe alguna hibridación entre orbitales de átomos diferentes? (digo diferentes pero también me refiero a dos átomos iguales).
Ivan, 10 Años Antes
Hola Iván. Hibridación como tal siempre es entre orbitales de un mismo átomo. Sin embargo, eso que comentas o intuyes es en realidad la teoría de orbitales moleculares, teoría que va más allá y es más complejas que la teoría del enlace de valencia en la que se enmarca la hibridación. La realidad es que los orbitales atómicos de todos los átomos de una molécula dan lugar a orbitales moleculares que pertenecen a la totalidad de la molécula, tanto enlazantes como no enlazantes (con pares libres, por ejemplo). Un saludo grande.
QuimiTube, 10 Años Antes
este es lo mejor gracias
juan, 9 Años Antes
¡De nada!
QuimiTube, 9 Años Antes
Hola!
actualmente estudio medicina y vemos mucha bioquímica, obviamente la química es esencial en toda la carrera. Sus vídeos me han servido bastante (los de hibridación mas que otros) y quisiera darles las gracias por esforzarse para que la gente tenga otros medios (como este) para aprender química.
Muchísimas Gracias!!!
María Fernanda Angulo Cepeda, 8 Años Antes
Hola María Fernanda, mil gracias por tu comentario, me alegra muchísimo que te haya servido nuestro contenido. Mucha suerte con tus estudios que son tan importantes. Un saludo grande.
QuimiTube, 8 Años Antes
Hola! Tengo que dar un final de química inorgánica en la universidad y vi los videos de acido-base, solubilidad, redox, cinética y ahora uniones químicas, realmente son muy buenos, tenés una facilidad para explicar clarísimo todo. Me encantan tus videos! Muchas gracias desde Argentina!
Erika, 7 Años Antes
¡Me alegra mucho! ¡Muchísimas gracias por tu comentario!
QuimiTube, 3 Años Antes
Bien explicado pero hay un error de método grave: Escribes en la pizarra con una letra tan pequeña que cuesta seguirte. Aunque está el texto de apoyo es fundamental que lo que escribes en la pizarra se vea bien. O escribes con letra grande para que pueda leerse o no escribas.
Jose Luis, 6 Años Antes
Enhorabuena. Explicas muy bien
jose, 4 Años Antes