¿Cómo se elimina el CO2 que exhalan los astronautas?
Escrito por Quimitube el 21 enero
Cuando los seres humanos respiran en una estancia cerrada herméticamente, que no tiene posibilidad de reciclar el aire interior por intercambio con el exterior (como ocurre con los submarinos o las naves espaciales) es necesario disponer de un «carbon dioxide scrubber», es decir, un dispositivo capaz de purificar el aire eliminando o absorbiendo CO2. Para ello se pueden utilizar distintos mecanismos, aunque en esta entrada nos vamos a centrar en la eliminación basada en una reacción química, utilizando el dióxido de carbono como un reactivo para convertirlo en un producto distinto. En concreto suelen usarse dos opciones: la reacción con aminas y la reacción con hidróxidos.

Las misiones Apollo de la NASA utilizaban hidróxido de litio para eliminar el dióxido de carbono del aire del interior de la nave espacial y purificarlo
Eliminación del dióxido de carbono por reacción con una amina
La reacción con aminas (-NH2) permite capturar el dióxido de carbono de forma reversible, lo cual permite, a su vez, regenerar después la disolución inicial liberando nuevamente el dióxido de carbono, generalmente por calentamiento. En general se podrían utilizar diversos tipos de aminas, aunque lo más frecuente es utilizar aminas primarias o secundarias que presenten grupos hidroxilo adicionales (-OH). La presencia de grupos alcohol es más para aumentar la solubilidad de la amina en agua que por la reacción de captación de dióxido de carbono en sí. Así, la reacción general de una amina con CO2 en solución acuosa puede escribirse como la siguiente reacción ácido-base:
R-NH2 + CO2 ⇔ RNHCOO– + H+
Como vemos se forma un compuesto que se desprotona, dando lugar a un anión y acidificando el pH del medio por la liberación de H+. Además, de ser útil la presencia de grupos hidroxilo, para este tipo de reacciones son muy adecuadas aquellas aminas primarias que presentan un gran impedimento estérico, es decir, que el grupo –NH2 se halla unido, por ejemplo, a un carbono terciario con grupos voluminosos; se ha visto que esto hace que sean más selectivas a la hora de captar uno otro gas (se pueden emplear para captar CO2, pero también otros gases como H2S), pero su producción es bastante cara y el factor económico limita su aplicación. Algunas de las aminas utilizadas más habituales son las siguientes:
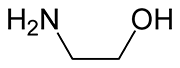
Estructura de la monoetanolamina (MEA)
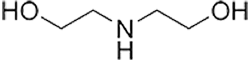
Estructura química de la dietanolamina (DEA)
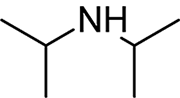
Estructura química de la diisopropilamina (DIPA)
La MEA ha sido reemplazada en muchos casos por otros sistemas más eficientes, es un compuesto útil porque es muy alcalino y porque resulta muy fácil revertir la reacción producida con CO2 aumentando la temperatura, ya que se trata de un compuesto sólo ligeramente básico. Además, presenta una elevada presión de vapor, lo que hace que se pueda perder compuesto por vaporización. Esto no ocurre con otras de las aminas utilizada, la DEA (dietanolamina) ya que tiene una presión de vapor muy baja y no se pierde por vaporización aunque se trabaje a bajas presiones, lo que a su vez hace que la regeneración sea más difícil. Otras aminas que se pueden utilizar para eliminar CO2 de una corriente de aire o de gas son la metildietanolamina (MDEA), la diglicolamina o la diisopropanolamina (DIPA). En general se trata de compuestos bastante tóxicos que se deben manipular con cuidado (por ejemplo, la MEA presenta una toxicidad de 3 sobre 4 en el llamado estándar NFPA 704 de Estados Unidos).
Eliminación del dióxido de carbono por reacción con un hidróxido
Otra forma de eliminar el dióxido de carbono del aire es por reacción con otro tipo de bases, en este caso bases fuertes como los hidróxidos. En concreto se utilizan dos: hidróxido de litio e hidróxido de sodio. Estas son las reacciones que se llevan a cabo para dar lugar a los correspondientes carbonatos de dichos metales alcalinos:
2NaOH(aq) + CO2(g) → Na2CO3(aq) + H2O(l)
2LiOH(aq) + CO2(g) → Li2CO3(aq) + H2O(l)
Se trata de reacciones fuertemente exotérmicas.
A diferencia de lo que ocurre en el caso de las aminas, la regeneración es mucho más compleja. En el caso del hidróxido de sodio, por ejemplo, implica la adición de hidróxido de calcio para recuperar el hidróxido de sodio y formar carbonato de calcio, que posteriormente se puede calentar para formar óxido de calcio, CaO, y liberar nuevamente el CO2. La mezcla del óxido de calcio con agua regenera el hidróxido de calcio adicionado inicialmente:
Na2CO3(aq) + Ca(OH)2(s) → 2NaOH(aq) + CaCO3(s)
CaCO3(s) → CaO(s) + CO2(g)
CaO(s) + H2O(l) → Ca(OH)2(s)
Para esta eliminación del CO2 también se puede utilizar el peróxido de litio, con mayor capacidad de absorción de dióxido de carbono por unidad de masa que el hidróxido de litio, con la ventaja añadida de que la reacción libera oxígeno gaseoso:
2 Li2O2 + 2 CO2 → 2 Li2CO3 + O2
Mas información:
Amine scrubbing for CO2 capture
The behavior and capabilities of litium hydroxide carbon dioxide scrubbers in a deep sea environment





Información Bitacoras.com
Valora en Bitacoras.com: Cuando los seres humanos respiran en una estancia cerrada herméticamente, que no tiene posibilidad de reciclar el aire interior por intercambio con el exterior (como ocurre con los submarinos o las naves espaciales) es necesa..…
Bitacoras.com, 10 Años Antes