Contenido del Vídeo
¿Qué es un catalizador y cuál es su mecanismo de actuación?
Existen sustancias, que no son ni los reactivos ni los productos, capaces de hacer que una reacción química transcurra a mayor velocidad. A dichas sustancias se las denomina catalizadores. Así, se puede definir un catalizador como una sustancia que aumenta la velocidad de reacción sin consumirse o sin alterarse durante la misma. Es decir, el catalizador permanece igual, por lo que es capaz de acelerar la reacción aun en cantidades muy pequeñas. Su mecanismo de acción se basa en disminuir la energía de activación de la reacción y, cuanto menor sea Ea, mayor será v. Al fenómeno se le denomina catálisis.
Según el catalizador se halle en el mismo estado de agregación de los reactivos o distinto, podemos tener dos tipos de catálisis, catálisis homogénea y catálisis heterogénea.
Catálisis heterogénea
La catálisis heterogénea es aquella en la que el catalizador se halla en una fase distinta, generalmente en estado sólido. Por ejemplo, el platino metálico o el pentaóxido de divanadio, V2O5, actúan como catalizadores en la reacción de formación de SO3 gaseoso:
![]()
Puesto que cualquiera de los dos catalizadores está en estado sólido y los reactivos y productos en estado gaseoso, se trata de catálisis heterogénea. En este tipo de catálisis, el catalizador es capaz de disminuir la energía de activación por adsorción de los reactivos en su superficie, lo que hace que los reactivos se encuentren más fácillmente, además de relajar y debilitar los enlaces. Cuanto mayor sea dicha superficie, es decir, más finamente dividido se halle el catalizador, mayor será su efecto sobre la velocidad.
Catálisis homogénea
La catálisis homogénea es aquella en la que todas las sustancias, reactivos, productos y catalizador, se halla en el mismo estado de agregación. En este caso, el catalizador actúa formando con los reactivos un complejo activado distinto y menos energético que el que se forma en su ausencia. Al tener este nuevo complejo activado menor energía, la energía de activación disminuye y la reacción se hace más rápida. Por ejemplo, la reacción que hemos visto previamente de formación de SO3, también puede ser catalizada por NO.
![]()
Mecanismo de acción de un catalizador
A continuación vemos un diagrama energético del mecanismo de acción de un catalizador:
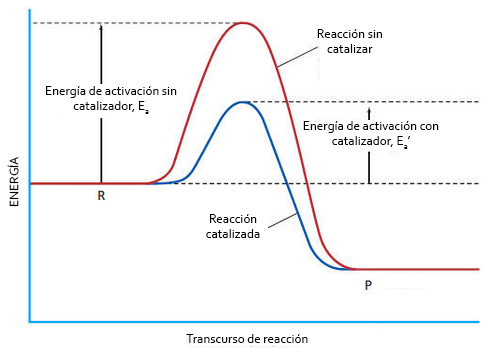
Diagrama energético de una reacción sin catalizador y con catalizador. Como podemos ver, la energía de activación de la segunda disminuye mucho,
lo que hace que la velocidad de reacción aumente. Sin embargo, los parámetros termodinámicos, y el rendimiento, no se modifican.
Ea: energía de activación de la reacción sin catalizador
Ea‘: energía de activación de la reacción con catalizador
Como vemos, Ea‘ << Ea
De este diagrama podemos deducir que un catalizador disminuye la energía de activación, pero no altera los parámetros termodinámicos como ΔH y ΔG, ya que estos dependen de la diferencia de energía entre reactivos y productos y estos valores no cambian por la presencia del catalizador. Asimismo, es importante incidir en que el catalizador no mejora el rendimiento de la reacción, únicamente hace que los productos se obtengan más rápidamente. Además, actúa tanto en la reacción directa como en la reacción inversa, como se puede observar en el diagrama.
¿Qué es un inhibidor?
Del mismo modo que existen catalizadores capaces de aumentar la velocidad de una reacción química, existen sustancias que actúan como catalizadores negativos o inhibidores, que pueden hacer que una reacción sea mucho más lenta o que ni siquiera transcurra a una velocidad apreciable. Por ejemplo, muchos conservantes alimentarios son inhibidores y actúan haciendo que las reacciones de deterioro de los alimentos transcurran a menor velocidad, así como sustancias utilizadas para evitar la oxidación de los metales.
Category: Cinética Química y Teoría de Cinética Química.
Etiquetas: Catalizadores y Energía de activación.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Buenas tardes, en un examen de selectividad preguntaron si la energía de activación de una reacción química está más relacionada con la energía de enlace de los átomos dentro de las moléculas que con la variación de la entalpía del proceso. ¿Cuál sería la respuesta?
María, 10 Años Antes
¡Hola! La entalpía del proceso, entendida como variación de entalpía entre productos y reactivos, no afecta a la energía de activación (que es la cima de la montaña). Sin embargo, alcanzar o no dicha energía de activación sí que depende de los enlaces entre los átomos ya que hay que romper los enlaces de los reactivos y formar los de los productos, y cuanto más difícil sea romper estos enlaces mayor será la energía de activación requerida.
QuimiTube, 10 Años Antes
Me pidieron siete reacciones químicas donde se utilice catalizador, tengo que escribir con su mecanismo de reacción…He buscado en google y no me aparecen…podrian ayudarme por favooor!!!!!
Ivis, 10 Años Antes
Te sugiero, por ejemplo, ver estas entradas:
http://www.quimitube.com/fabricacion-industrial-acido-nitrico
http://www.quimitube.com/produccion-acido-sulfurico-metodo-camaras-de-plomo
http://www.quimitube.com/fabricacion-acido-sulfurico-metodo-de-contacto
http://www.quimitube.com/produccion-industrial-amoniaco-sintesis-de-haber-principio-le-chatelier
Aquí podrás sacar algunas de ellas.
QuimiTube, 10 Años Antes
Hola Amigos, podrían por favor ayudarme con ejemplos de catalisis homogenea (usos industriales o algo relacionado), de antemano gracias y saludos cordiales
p.d Soy de Chile y sus videos son excelentes, gran aporte
Claudio Zavala Ovalle, 9 Años Antes
la verdad no entiendo no puede amostrar un ejercicio q sea mas entendible para poder entenderlo es q quiero realizar mi tarea de quimica pero no puedo si fuera con un ejercicio podria entender .
GRACIAS.
Monica fueltala, 5 Años Antes
¡Hola! Como verás estás en un vídeo de teoría, pero tienes muchos vídeos de ejercicios de cinética química que también van de menor a mayor dificultad. Te sugiero que le eches un vistazo al contenido completo: https://www.quimitube.com/videoscategory/cinetica-quimica/
QuimiTube, 5 Años Antes